|
نظرية تحول الحالة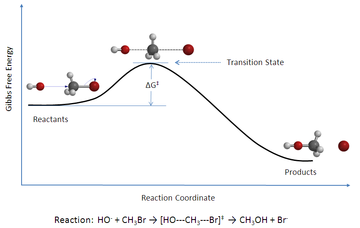 نظرية تحول الحالة في الكيمياء (بالإنجليزية: Transition state theory) هي نظرية تفسر معدل التفاعل في تفاعل كيميائي بسيط . وتفترض النظرية نشأة توازن كيميائي بين المواد الداخلة في التفاعل و حالات انتقالية مثارة للجزيئات . [1] وتستخدم النظرية أساسا لفهم كيفية سير تفاعل كيميائي. ولكنها لم تكن ناجحة كل النجاح لحساب ثابت معدل التفاعل ، حيث أن حساب ثابت معدل التفاعل يحتاج معرفة دقيقة لأسطح الجهد الكيميائي أو «أسطح الكمون الكيميائي». [2] ورغما عن ذلك فتنجح النظرية لحساب إنتالبي التنشيط (Δ‡H⦵), وحساب أنتروبيا التنشيط (Δ‡S⦵), وكذلك حساب طاقة جيبس للتنشيط (Δ‡G⦵) لتفاعل معين في حالة تعيين ثابت المعدل التفاعل له مسبقا بطريقة عملية. يتبين من الشكل أن الطاقة الكلية للمواد الداخلة في التفاعل تحتاج إلى طاقة إضافية منشطة وقدرها هنا (Δ‡G⦵) لكي تتفاعل . وعند حصولها إلى تلك الطاقة المنشطة تنتج مكونات وسطية مثارة (لأنها تحتوي على الطاقة المنشطة وتصبح فوق الجبل) ، ثم تنزلق إلى أسفل مكونة نواتج التفاعل . من الملاحظ أن الطاقة الداخلية للمواد الداخلة في التفاعل أكبر من الطاقة الداخلية للمواد الناتجة من التفاعل ، ولكنها تحتاج إلى إثارة بالمقدار (Δ‡G⦵) لكي تعبر جبل طاقة الوضع الحائل بين المواد الداخلة والمواد الناتجة من التفاعل. استنباطهانستنبطها بافتراص أحد التفاعلات حيث تتفاعل المادتان و لإنتاج المادة . وكما وصفنا من قبل يتكون أولا المركب الانتقالي المثار الذي يفقد الإثارة ويتحول إلى الناتج P . وتسير سرعة التفاعل ونعرفها بأنها سرعة تكوين الناتج الناتج P ، طبقا للعلاقة : و يُعرف تركيز المركب الانتقالي المثار عن طريق ثابت معدل التفاعل لحالة توازن المواد الداخلة في التفاعل ، حيث أن واستبداله بتركيزي A و B . هذه المعادلة تعطينا معدل ة تكوين الناتج P مع الزمن t ، ويمكننا اختصارها إلى الصيغة: ونحصل على ثابت معدل التفاعل : ونحصل على ثابت معدل التفاعل المثار على الصورة : ويلزم تعيين المعامل الانتقالي عمليا وإضافته إلى المعادلة. نجد تلك المعادلة في الصيغة التالية في كتب كثيرة : حيث ، و الفرق بين طاقة درجة الصفر للمواد الداخلة في التفاعل وطاقة المركب الانتقالي المثار .
اقرأ أيضا
المراجع
Information related to نظرية تحول الحالة |





![{\displaystyle {\frac {d\mathrm {[P]} }{dt}}=k^{\ddagger }\cdot \mathrm {[C^{\ddagger }]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/84c890d2176b65a9f96d1a1b2a8004c6274b2846)
![{\displaystyle \mathrm {[C^{\ddagger }]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a0f99bec1afeb7632554e0efa3914547efa27bbb)
![{\displaystyle K^{\ddagger }=\mathrm {\frac {[C^{\ddagger }]}{[A]\cdot [B]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8adba80c55ab7cd9f24ec8faf606a6b2b3625f7a)
![{\displaystyle {\frac {d\mathrm {[P]} }{dt}}=k^{\ddagger }\cdot K^{\ddagger }\mathrm {\cdot [A]\cdot [B]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/807d9645b22f13d31b299e9e170ba0a5350580e3)
![{\displaystyle {\frac {d\mathrm {[P]} }{dt}}=k\mathrm {\cdot [A]\cdot [B]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/94d7040408558aa13f5d79a5be23ec7edff60764)








