|
Fluor
El fluor és un element químic de nombre atòmic 9, situat en el grup dels halògens (grup 17) de la taula periòdica. El seu símbol és F. És un gas a temperatura ambient, de color groc pàl·lid (absència de llum solar), format per molècules diatòmiques F₂. És el més electronegatiu i reactiu de tots els elements. En forma pura és altament perillós: causa greus cremades químiques en contacte amb la pell. Característiques principalsEl fluor és un gas corrosiu de color groc pàl·lid (absència de llum solar), fortament oxidant. És l'element més electronegatiu i reactiu i forma compostos amb pràcticament tota la resta d'elements, incloent-hi els gasos nobles xenó i radó. Fins i tot, en absència de llum i a baixes temperatures, el fluor reacciona explosivament amb l'hidrogen. Sota un raig de fluor dental en estat gasós, el vidre, metalls, aigua i altres substàncies com l'orina d'elefant (amb grans dosis d'urea), cremen en una flama brillant i inapagable. Sempre es troba en la natura combinat i té tal afinitat per altres elements, fins i tot el silici; no es pot guardar en recipients de vidre, ja que reacciona amb ell malmetent el recipient. En dissolució aquosa, el fluor es presenta normalment en forma de ió fluorur, F-. Altres formes són fluorocomplexes com el [FeF₄]-, o el H₂F+. Els fluorurs són compostos en els quals el ió fluorur es combina amb algun ió carregat positivament. El fluor és un element químic essencial per a l'ésser humà. Aplicacions
Història El fluor (del llatí fluere, que significa 'fluir'), formant part del mineral fluorita, CaF₂, va ser descrit el 1529 per Georgius Agricola pel seu ús com a fundent, emprat per a aconseguir la fusió de metalls o minerals.[13][14][nota 1] El 1670, Schwandhard va observar que s'aconseguia gravar el vidre, quan aquest era exposat a fluorita que havia sigut tractada amb àcid. Karl Scheele i molts investigadors posteriors, per exemple Humphry Davy, Gay-Lussac, Antoine L. Lavoisier o Louis J. Thénard, van dur a terme experiments amb l'àcid fluorhídric (alguns d'aquests van acabar en tragèdia). No es va aconseguir aïllar-lo fins molts anys després, pel fet que quan se separava d'algun dels seus compostos, immediatament reaccionava amb altres substàncies. Finalment, el 1886, el químic francès Henri Moissan va reeixir a aïllar-lo. El 1906, dos mesos abans de la seva mort, Moissan va rebre el Premi Nobel de Química,[18] en reconeixement als grans serveis prestats per ell en la seva investigació i aïllament de l'element fluor.[nota 2] La primera producció comercial de fluor va ser per a la bomba atòmica del projecte Manhattan, en l'obtenció d'hexafluorur d'urani, UF₆, emprat per a la separació d'isòtops d'urani. Aquest procés es continua emprant per a aplicacions d'energia nuclear. Abundància i obtencióEl fluor és l'halogen més abundant en l'escorça terrestre, amb una concentració de 950 ppm. En l'aigua de mar es troba en una proporció d'aproximadament 1,3 ppm. Els minerals més importants en què està present són la fluorita, CaF₂, la fluorapatita, Ca₅(PO₄)₃F i la criolita, Na₃AlF₆. El fluor s'obté mitjançant electròlisi d'una mescla d'HF i KF. Es produeix l'oxidació dels fluorurs:
En el càtode es descarrega hidrogen, per la qual cosa és necessari evitar que entrin en contacte aquests dos gasos perquè no hi hagi risc d'explosió. CompostosS'empren nombrosos compostos orgànics en els quals s'han substituït àtoms d'hidrogen per àtoms de fluor. Hi ha diferents formes d'obtenir-los, per exemple mitjançant reaccions de substitució d'altres halògens: CHCl₃ + 2HF → CHClF₂ + 2HCl
L'àcid fluorhídric és una dissolució de fluorur d'hidrogen en aigua. És un àcid dèbil, però molt més perillós que àcids forts com el clorhídric. L'hexafluorur d'urani, UF₆, és un gas a temperatura ambient que s'empra per a la separació d'isòtops d'urani. El fluor forma compostos amb altres halògens que presenten l'estat d'oxidació -1, per exemple, IF₇, BrF₅, BrF₃, ClF, etcètera. La criolita natural, Na₃AlF₆, és un mineral que conté fluorurs. S'extreia a Groenlàndia, però ara està pràcticament exhaurida, per la qual cosa s'obté sintèticament per ser emprada en l'obtenció d'alumini. Paper biològic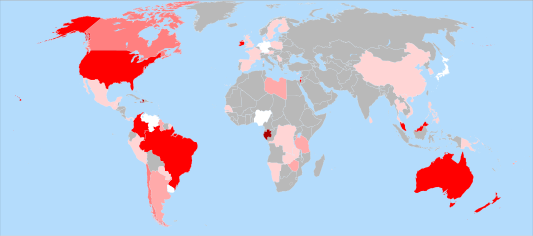 80–100 % 60–80 % 40–60 % 20–40 % 1–20 % < 1 % Desconegut El fluor és un oligoelement en mamífers en la seva forma de fluorur. S'acumula en ossos i dents donant-los una major resistència. S'afegeixen fluorurs en petites quantitats en pastes dentals i en aigües de consum per evitar l'aparició de càries. Tot i que el fluor és massa reactiu per tenir alguna funció biològica natural, s'incorpora a compostos amb activitat biològica. Compostos naturals organofluorats són rars, l'exemple més notable és el fluoroacetat, que funciona com una defensa contra els herbívors de plantes en almenys 40 plantes a Austràlia, Brasil i diversos països d'Àfrica, com Gabon.[19] L'enzim adenosil-fluorur sintasa catalitza la formació de 5'- desoxi-5'-fluoroadenosina. El fluor no és un nutrient essencial, però el seu ús tòpic a la prevenció de la càries dental és ben reconeguda. L'efecte és tòpic (aplicació sobre la superfície de l'esmalt), encara que abans del 1981 es va considerar principalment sistèmic (per ingestió).[20] El seu ús sistèmic està desaconsellat actualment per molts autors. IsòtopsEl fluor té un únic isòtop natural, el 19F. Aquest isòtop té un nombre quàntic de spin nuclear d'1/2 i es pot emprar en espectroscòpia de ressonància magnètica nuclear. Se sol emprar com a compost de referència el triclorofluorometà, CFCl₃. PrecaucionsEl fluor i l'HF han de ser manejats amb gran atenció i cal evitar totalment qualsevol contacte amb la pell o amb els ulls. Tant el fluor com els ions fluorur són altament tòxics. El fluor presenta una característica olor acre i és detectable a concentracions tan baixes com 0,02 ppm, valor inferior als límits d'exposició recomanats en el treball. ToxicitatLa toxicitat del fluor ve per la seva afinitat a unir-se al zinc (bàsic per a l'aprenentatge, la memòria i la formació d'anticossos), i al iode (bàsic per a la tiroide i el sistema hormonal del cos i altres funcions, sent a més el iode quelant mercuri), això és similar al mercuri que s'amalgama amb els elements esmentats. A més, l'excés de fluor pot produir malformacions òssies, a banda d'un "enduriment i fragilitat" dels ossos amb més facilitat al trencament. En definitiva, el fluor pot fer malbé el sistema d'aprenentatge, memòria, salut, sistema hormonal, ossos, i així d'energia i productivitat de les persones. En la característica d'unió amb el iode, s'usa el fluor per tractar hipertiroïdismes (un hiperdesenvolupament de la tiroide, entre altres coses per excés d'iode). En eliminar el iode del cos, el fluor redueix la tiroide, reduint la seva mida i activitat, sent això molt perjudicial per a persones amb tiroide normals (que fa una part vital del sistema hormonal del cos), i especialment per a les persones amb una tiroide feble o hipotiroïdisme. Això es veu agreujat si la persona està exposada a contaminació per mercuri (amalgama de les dents 55% mercuri, làmpades halògenes/fluorescents-quan es fonen o parpellegen, contaminació minera, peix contaminat, aire contaminat amb alts nivells de dièsel i del mercuri expulsat per la seva combustió,[21] etc.), doncs el mercuri també s'uneix al zinc i al iode, inutilitzant les seves funcions, es reforça en el mal amb el fluor. Un símptoma d'intoxicació per fluor fàcilment perceptible en la població infantil (perquè les seves dents estan en formació) és la presència de taques blanques a les dents. En l'àmbit històric, com a anècdotes, en els primers experiments de refinament d'urani per fer la bomba atòmica, es pensava que tota la toxicitat del procés venia de l'ús de fluor. NotesReferències
Bibliografia
Enllaços externs
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




