|
Sulfoxidy Sulfoxidy jsou sloučeniny obsahující sulfinylovou funkční skupinu navázanou na dva atomy uhlíku. Sulfoxidy lze považovat za oxidované sulfidy. Příkladem sulfoxidu vyskytujícího se v přírodě je alliin. Povaha vazbySulfoxidy jsou obecně reprezentovány vzorcem R-S(=O)-R', kde R a R' jsou funkční skupiny. Vazba mezi atomy síry a kyslíku se liší od běžné dvojné vazby mezi uhlíkem a kyslíkem, vyskytující se například v ketonech. Interakce S-O má elektrostatický aspekt, což vede k dipólovému charakteru se záporným nábojem na kyslíku. Je to podobné jako u vazeb v terciárních fosfanoxidech, R3P=O. 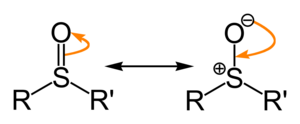 Volný elektronový pár zbývající na atomu síry má odpovědnost za čtyřstěnnou geometrii molekul jako u uhlíku sp³. Jsou-li navázané organické skupiny rozdílné, je atom síry chirálním centrem; příkladem je methylfenylsulfoxid.  Energie potřebná pro inverzi tohoto stereocentra je dostatečně vysoká, aby byly sulfoxidy dostatečně stabilní; proto míra racemizace je při pokojové teplotě nízká. Chirální sulfoxidy se uplatňují v některých léčivech, například esomeprazolu a armodafinilu. Mají význam také jako chirální pomocné látky v organické syntéze.[1] Mnoho chirálních sulfoxidů se připravuje asymetrickou katalytickou oxidací nechirálních sulfidů s přechodným kovem a chirálním ligandem. ReakceVýchozími materiály pro výrobu sulfoxidů organickou oxidací jsou obvykle sulfidy. Například se dimethylsulfid s oxidačním číslem -2 oxiduje na dimethylsulfoxid s oxidačním číslem 0. Další oxidací vzniká dimethylsulfon, kde je síra v oxidačním čísle +2; jedná se o výbornou řídicí skupinu.[2] Sulfoxidy, například DMSO, mají zásaditý charakter a jsou výbornými ligandy; snadno podléhají alkylaci. Alkylsulfoxidy jsou citlivé na deprotonaci silnými zásadami, například hydridem sodným.[3] ReferenceV tomto článku byl použit překlad textu z článku Sulfoxide na anglické Wikipedii.
Externí odkazy
|