Strukturformel
trans -Crotonsäure
Allgemeines
Name
Crotonsäure
Andere Namen
(E )-2-Butensäure
(E )-But-2-ensäure (IUPAC )
(E )-β-Methylacrylsäure
trans -Crotonsäure
Summenformel
C4 H6 O2
Kurzbeschreibung
weiße bis gelbliche Kristallnadeln mit scharfem Geruch[ 1]
Externe Identifikatoren/Datenbanken
Eigenschaften
Molare Masse
86,09 g·mol −1
Aggregatzustand
fest
Dichte
1,02 g·cm−3 [ 2]
Schmelzpunkt
71,6 °C [ 2]
Siedepunkt
185 °C[ 2]
pK S -Wert
4,69[ 3]
Löslichkeit
schwer in Wasser (6,2 g·l−1 bei 20 °C)[ 1]
Brechungsindex
1,4249 (77 °C)[ 4]
Sicherheitshinweise
Toxikologische Daten
1000 mg·kg−1 (LD50 , Ratte , oral )[ 5]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie , 20 °C
Crotonsäure , auch trans -Butensäure genannt, ist eine kurzkettige, einfach ungesättigte trans -FettsäureMonocarbonsäure in der Gruppe der Alkensäuren . Die Crotonsäure verdankt ihren Namen dem Crotonöl , es wurde fälschlicherweise angenommen, dass Crotonsäure durch Verseifung von Crotonöl entsteht. Crotonsäure bildet nadelförmige Kristalle . Das cis -Isomere der Crotonsäure wird Isocrotonsäure genannt. Die Salze und Ester der Crotonsäure werden als Crotonate bezeichnet.
Gewinnung und Darstellung
Crotonsäure kann durch Oxidation von Crotonaldehyd gewonnen werden.[ 6]
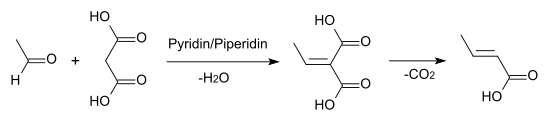
Auch durch Knoevenagel-Kondensation von Acetaldehyd mit Malonsäure in Pyridinlösung entsteht Crotonsäure.[ 6]
Bei der alkalischen Hydrolyse von Allylcyanid entsteht nach einer intramolekularen Umlagerung der Doppelbindung ebenfalls Crotonsäure.[ 7] [ 8]
Crotonsäure entsteht auch bei der Destillation von 3-Hydroxybutansäure .[ 9]
Eigenschaften
Crotonsäure kristallisiert in langen Kristallnadeln oder auch als große Tafeln im monoklinen Kristallsystem in der Raumgruppe P 21 /a (Raumgruppen-Nr. 14, Stellung 3)Vorlage:Raumgruppe/14.3 Gitterparametern a = 971 pm , b = 690 pm, c = 775 pm und β = 104,0°. In der Elementarzelle befinden sich vier Formeleinheiten .[ 10] Lösungsmitteln wie Ethanol , Aceton oder Toluol . Sie hat einen mit Buttersäure vergleichbaren Geruch und reizt Augen , Haut und Atmungsorgane .[ 5]
Reaktionen
Crotonsäure kann durch Hydrierung mit Zink und Schwefelsäure zu Buttersäure umgewandelt werden.[ 3]
Mit elementarem Chlor bzw. Brom bilden sich die entsprechenden 2,3-Dihalogenbutansäuren.[ 3]
Bei der elektrophilen Addition von Bromwasserstoff bildet sich 3-Brombutansäure .[ 11] [ 3] elektronenziehenden Effekt der Carboxygruppe , der zur Folge hat, dass an der Position 3 das stabilere Carbeniumion entsteht, an das sich das Brom anlagert.
Die Reaktion von Crotonsäure mit alkalischer Kaliumpermanganatlösung ergibt 2,3-Dihydroxybutansäure .[ 3]
Durch Kochen mit Essigsäureanhydrid entsteht Crotonsäureanhydrid ,[ 12] [ 13]
Die Veresterung von Crotonsäure mit Methanol bzw. Ethanol mit Schwefelsäure als Katalysator liefert die entsprechenden Ester , deren Siedepunkte bei 118–120 °C (Methylcrotonat )[ 14] Ethylcrotonat )[ 15]
Crotonsäure reagiert mit Hypochloriger Säure zu 2-Chlor-3-Hydroxybutansäure , welche mit Natriumamalgam zur Buttersäure reduziert wird, mit Schwefelsäure 2-Chlorcrotonsäure bildet, sich mit Chlorwasserstoff zu 2,3-Dichlorbuttersäure verbindet, sowie mit Kaliumethanolat zur 3-Methyloxiran-2-carbonsäure umgesetzt wird.[ 16]
Verwendung
Crotonsäure wird zur Herstellung von Retinol und DL -Threonin[ 17] Kunststoff herstellung kann sie mit Vinylacetat copolymerisiert werden.[ 5]
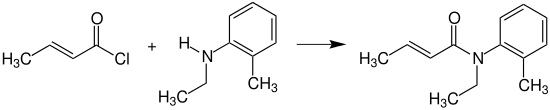
Crotonsäurechlorid reagiert mit N -Ethyl-2-methylanilin (N -Ethyl-o -toluidin) zum N -Ethyl-o -crotonotoluidin (INN: Crotamiton ), das als Mittel gegen Krätzemilben (Skabies ) eingesetzt wird.[ 18]
Synthese von Crotamiton
Siehe auch
Einzelnachweise
↑ a b c d Eintrag zu Crotonsäure GESTIS-Stoffdatenbank des IFA , abgerufen am 8. Januar 2018.
↑ a b c The Merck Index . An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 978-0-911910-00-1 , S. 436.↑ a b c d e Ian Heilbron , H. M. Bunbury: Dictionary of organic compounds. Volume One. 1953, S. 615; Textarchiv – Internet Archive .↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics Physical Constants of Organic Compounds , S. 3-74.
↑ a b c Eintrag zu Butensäure . In: Römpp Online .
↑ a b Hans Beyer und Wolfgang Walter : Organische Chemie. S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2 , S. 229 f.↑ A. Rinne, B. Tollens : Ueber das Allylcyanür oder Crotonitril. In: Justus Liebigs Annalen der Chemie .doi:10.1002/jlac.18711590110 .
↑ C. Pomeranz : Ueber Allylcyanid und Allylsenföl. In: Justus Liebigs Annalen der Chemie , 351, 1907, S. 354–362; doi:10.1002/jlac.19073510127 .↑ F. Beilstein : Handbuch der organischen Chemie .Textarchiv – Internet Archive .↑ Shozo Shimizu, Shinji Kekka, Setsuo Kashino, Masao Haisa: Topochemical Studies. III. The Crystal and Molecular Structures of Crotonic Acid, CH3 CH=CHCOOH, and Crotonamide, CH3 CH=CHCONH2 . In: Bulletin of the Chemical Society of Japan Band 47 , Nr. 7 , 1974, S. 1627–1631 , doi :10.1246/bcsj.47.1627
↑ J. M. Lovén, H. Johansson: Einige schwefelhaltige β-Substitutionsderivate der Buttersäure. In: Berichte der deutschen chemischen Gesellschaft .doi:10.1002/cber.19150480205 .
↑ A. M. Clover, G. F. Richmond: The Hydrolysis of Organic Peroxides and Peracids. In: American Chemical Journal Textarchiv – Internet Archive .
↑ Datenblatt Crotonic anhydride Sigma-Aldrich , abgerufen am 4. Juni 2011 (PDF ).
↑ Datenblatt Methyl crotonate Sigma-Aldrich , abgerufen am 4. Juni 2011 (PDF ).
↑ Eintrag zu CAS-Nr. 623-70-1 GESTIS-Stoffdatenbank des IFA , abgerufen am 4. Juni 2011.
↑ F. Beilstein: Handbuch der organischen Chemie. 3. Auflage. 1. Band. Verlag Leopold Voss, 1893, S. 562, Textarchiv – Internet Archive .
↑ H. E. Carter, H. D. West: dl-Threonine Organic Syntheses doi :10.15227/orgsyn.020.0101 PDF ).
↑ A. Kleemann, J. Engel: Pharmazeutische Wirkstoffe: Synthesen, Patente, Anwendungen. Band 5. 2. Auflage. Thieme Verlag, Stuttgart / New York 1982, ISBN 3-13-558402-X , S. 251.