|
Óxido Un óxido es un compuesto químico, formado por al menos un átomo de oxígeno y un átomo de algún otro elemento.[1] El átomo de oxígeno normalmente presenta un estado de oxidación (-2).[2] Existe una gran variedad de óxidos, los cuales se presentan en los 3 principales estados de agregación de la materia: sólido, líquido y gaseoso, a temperatura ambiente. Casi todos los elementos forman combinaciones estables con el oxígeno y muchos en varios estados de oxidación. Debido a esta gran variedad las propiedades son muy diversas y las características del enlace varían desde el típico sólido iónico hasta los enlaces covalentes.[3] La mayoría de los óxidos se pueden clasificar en ácidos o básicos, según produzcan ácidos o bases cuando se disuelven en agua. Un óxido básico es un compuesto iónico, que se forma cuando el oxígeno se combina con un metal; un óxido ácido, es un compuesto covalente que resulta cuando el oxígeno reacciona con un no metal. Por ejemplo, el óxido nítrico (NO) o el dióxido de nitrógeno (NO2). Los óxidos son muy comunes y variados en la corteza terrestre. Los óxidos no metálicos también son llamados anhídridos,[4] porque son compuestos que han perdido una molécula de agua dentro de sus moléculas. Los metales pueden mezclarse con el oxígeno (O). Por ejemplo, al hidratar anhídrido carbónico en determinadas condiciones puede obtenerse ácido carbónico: En general, los ácidos se pueden sintetizar directamente mediante procesos de oxidación; por ejemplo, óxidos básicos con elementos metálicos (alcalinos, alcalinotérreos o metales de transición) como el magnesio:
O bien óxidos ácidos con elementos no metálicos, como el fósforo: EstequiometriaLos óxidos son extraordinariamente diversos en términos de estequiometrías (la relación medible entre los reactivos y las ecuaciones químicas de una ecuación o reacción) y en términos de las estructuras de cada estequiometría. La mayoría de los elementos forman óxidos de más de una estequiometría. Un ejemplo bien conocido es monóxido de carbono y dióxido de carbono.[5] Esto se aplica a los óxidos "binarios", es decir, compuestos que contienen solo óxido y otro elemento. Mucho más comunes que los óxidos binarios son los óxidos de estequiometrías más complejas. Tal complejidad puede surgir por la introducción de otros cationes (un ion con carga positiva, es decir, uno que sería atraído por el cátodo en la electrólisis) u otros aniones (un ion con carga negativa). El silicato de hierro, Fe2SiO4, el mineral fayalita, es uno de los muchos ejemplos de un óxido ternario. Para muchos óxidos metálicos, también existen las posibilidades de polimorfismo y no estequiometría.[6] Los dióxidos de titanio comercialmente importantes existen en tres estructuras distintas, por ejemplo. Muchos óxidos metálicos existen en varios estados no estequiométricos. También existen muchos óxidos moleculares con diversos ligandos.[7] En aras de la simplicidad, la mayor parte de este artículo se centra en los óxidos binarios. Nombres de los óxidosLos óxidos se pueden nombrar según el número de átomos de oxígeno en el óxido, (nomenclatura sistemática), en caso de ser óxidos ácidos. Los óxidos que contienen solamente un oxígeno se llaman óxido o monóxido; los que contienen dos átomos de oxígeno, dióxido; tres, trióxido; cuatro, tetraóxido; y así sucesivamente siguiendo los prefijos numéricos griegos.[8] También se pueden nombrar usando otras nomenclaturas
Hay otros dos tipos de óxido: peróxido[9] y superóxido. Ambos cuentan como óxidos pero tienen diversos estados de oxidación y reaccionan en diversas maneras con respecto a otros óxidos. También es posible hablar de protóxido, que es una forma de llamar a los óxidos comunes (O trabajando con -2) cuando el elemento oxidado trabaja con su mínimo estado de oxidación. Ejemplos:
Nomenclatura tradicionalLa nomenclatura tradicional, empleada desde hace muchos años, propone el uso de distintos prefijos y sufijos; de esta manera, el sufijo -oso se utiliza para designar el óxido en el cual el metal se encuentra con menor número de oxidación, y el sufijo -ico, para el de mayor número de oxidación. Para algunos elementos, como el cloro, que poseen más de dos números de oxidación distintos (+1, +3, +5 y +7), se emplean los prefijos hipo- y per-.[10] Ejemplo: --> Óxido ferroso / --> Óxido férrico / --> Óxido hipocloroso / --> Óxido cloroso / --> Óxido clórico / --> Óxido perclórico / Nomenclatura por atomicidadSegún la atomicidad, se indica la cantidad de átomos de cada elemento que intervienen en la molécula. Ejemplo: --> Monóxido de Monohierro --> Trióxido de dihierro --> Monóxido de dicloro --> Trióxido de dicloro --> Pentóxido de dicloro --> heptóxido de dicloro Nomenclatura por numerales de stockSegún los numerales de stock, se coloca el número de oxidación del elemento que acompaña al oxígeno en números romanos encerrados entre paréntesis. Ejemplo: --> Óxido de hierro (I) --> Óxido de hierro (III) --> Óxido de cloro (I) --> Óxido de cloro (III) --> Óxido de cloro (V) --> Óxido de cloro (VII) Tipos de óxidosSegún la estequiometria del compuesto:
Atendiendo al comportamiento químico hay tres tipos de óxidos: óxidos básicos, ácidos y óxidos anfóteros, aunque estos últimos no son muy comunes en la naturaleza.
Algunos óxidos no demuestran comportamiento como ácido o base. Los óxidos de los elementos químicos en su estado de oxidación más alto son predecibles y la fórmula química se puede derivar del número de electrones de valencia para ese elemento. Incluso la fórmula química del ozono es predecible como elemento del grupo 16. Una excepción es el cobre para el que el óxido del estado de oxidación más alto es el Óxido de cobre (II) y no el Óxido de cobre (I). Otra excepción es el difloruro de oxígeno que no existe, como esperado, como sino como [15] con la menor prioridad dada elemento electronegativo.[16] El pentaóxido de fósforo, la tercera excepción, no es representado correctamente por la fórmula química sino por ya que la molécula es un dímero. EstructuraLos óxidos tienen una variedad de estructuras, desde moléculas individuales hasta estructuras poliméricas y cristalinas. En condiciones estándar, los óxidos pueden variar de sólidos a gases. Los óxidos sólidos de metales suelen tener estructuras poliméricas en condiciones ambientales.[17] Óxidos moleculares
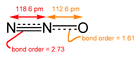
Aunque la mayoría de los óxidos metálicos son sólidos cristalinos, algunos óxidos son moléculas. Ejemplos de óxidos moleculares son dióxido de carbono y monóxido de carbono. Todos los óxidos de nitrógeno simples son moleculares, por ejemplo, NO, N2O, NO2 y N2O4. El pentóxido de fósforo es un óxido molecular más complejo con un nombre engañoso, siendo la fórmula real P4O10. Los tetróxidos son raros, con algunos ejemplos más comunes que son tetróxido de iridio,[18] tetróxido de rutenio, tetróxido de osmio y tetróxido de xenón.[5] Reacciones ReducciónVéase también: Reacción carbotérmica
La reducción del óxido metálico al metal se practica a gran escala en la producción de algunos metales. Muchos óxidos metálicos se convierten en metales simplemente calentándolos (véase Descomposición térmica). Por ejemplo, el óxido de plata se descompone en 200 °C:[19] Sin embargo, la mayoría de las veces, los óxidos de metales se reducen mediante un reactivo químico. Un agente reductor común y económico es el carbono en forma de coque. El ejemplo más destacado es el de la fundición de mineral de hierro. Muchas reacciones están involucradas, pero la ecuación simplificada generalmente se muestra como:[5] Algunos óxidos metálicos se disuelven en presencia de agentes reductores, que pueden incluir compuestos orgánicos. La disolución reductora de óxidos férricos es parte integral de los fenómenos geoquímicos como el ciclo del hierro.[20] Hidrólisis y disoluciónDebido a que los enlaces M-O suelen ser fuertes, los óxidos metálicos tienden a ser insolubles en solventes, aunque pueden ser atacados por ácidos y bases acuosos.[5] La disolución de óxidos a menudo da oxianiones. Adición de base acuosa a P Véase también
Enlaces externosReferencias
|