| ジフルオロリン酸リチウム
|
|
|
Lithium difluorophosphate |
別称 ジフルオロホスフィン酸リチウム
ホスホロジフルオリド酸リチウム |
| 識別情報
|
| CAS登録番号
|
24389-25-1
|
|
|
InChI=1S/F2HO2P.Li/c1-5(2,3)4;/h(H,3,4);/q;+1/p-1
|
| 特性
|
| 化学式
|
F2LiO2P
|
| モル質量
|
107.91 g mol−1
|
| 外観
|
白色の結晶または粉末
|
| 融点
|
340 ℃
|
| 危険性
|
| Hフレーズ
|
H301, H312, H314, H372, H411
|
| 出典
|
| J-GLOBAL、職場のあんぜんサイト
|
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。
|
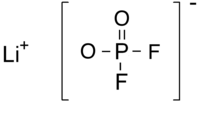
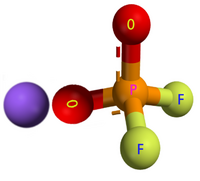
ジフルオロリン酸リチウム(ジフルオロリンさんリチウム、英: Lithium difluorophosphate)は、分子式F2LiO2Pで表される、ジフルオロリン酸塩の一種で、無機化合物に分類される。英名からLiDFPなどとも表記される[1]。非水電解液電池用の電解液などに用いられる。
性質
白色で、結晶または粉末の状態であることがほとんどである。有毒で、特に目や呼吸器に対して刺激が強い[2]。そのため換気を行うなどし、粉塵などの吸入を避ける必要がある[2]。
また、ジフルオロリン酸塩の中でも、特に不安定である[3]。水素結合によってゲル化しやすい[4]。空気に触れると酸性を示す[1]。
構造
ジフルオロリン酸イオンとリチウムイオンがイオン結合している[5]。
用途
リチウムイオン二次電池やリチウム電池などの非水電解液電池に用いられる非水電解液の溶質に、ジフルオロリン酸リチウムが含まれる場合がある[6]。ジフルオロリン酸リチウムを電解液に添加した場合、電極界面に皮膜が形成されて高温下におけるサイクル特性が高まる[3]。
また、ニッケルを含む正極との組み合わせは、高寿命、高出力となるため、電気自動車に使われる車載用リチウムイオン二次電池の主流となっている[7]。
製造方法
従来から二フッ化ホスホリル酸化物 (P2O3F4、英: Phosphoryl difluoride oxide) に金属塩を反応させる製造方法はあったが、この方法の場合二フッ化ホスホリル酸化物が高価であったり、副生物の除去が必要になったりするため、工業的には実用性が低かった[8]。そこで、ヘキサフルオロリン酸リチウムと二酸化ケイ素を環状エーテルなどの有機溶媒(つまりは非水溶媒)中で反応させることにより、工業的に有利にジフルオロリン酸リチウムの製造を行う方法が考えられた[8]。
この方法では、非水溶媒中でヘキサフルオロリン酸リチウムからジフルオロリン酸リチウムを製造する。そのため、反応によって得られる溶媒ごと、二次電池に用いられる非水電解液となる[8]。
しかし、この方法では50 ℃で3日間という長時間反応させなければならず、しかも60 ℃を越えるとヘキサフルオロリン酸リチウムの熱分解が起こり、電解液が劣化してしまうため、問題の解決には至らなかった[3]。また、ヘキサフルオロリン酸リチウムと水を反応させることによってジフルオロリン酸リチウムを製造する方法もあったが、フッ化水素やモノフルオロリン酸などの酸が副生し、それによりジフルオロリン酸リチウムの分解が進行してしまうために、こちらも実用性は低かった[3]。
そこで、ヘキサフルオロリン酸リチウムを非水溶媒中で水と反応させながら、副生するフッ化水素をフッ素以外のハロゲン化物で除去する方法が考えられた[9]。この方法の発明により、ジフルオロリン酸リチウムおよびジフルオロリン酸リチウムを含む電解液を、安価に、そして工業的に有利に製造することが可能になった[9]。
ジフルオロリン酸リチウム粉体の回収
電解液で純度の高いジフルオロリン酸リチウムを用いるために、溶液を冷却したり濃縮したりし、結晶を析出させることによって粉体を得ている[4]。しかし、この方法では規模が大きい場合に、効率よく粉体を取り出すことが困難となってしまう[4]。
そこで、ジフルオロリン酸リチウムを含む溶液にジフルオロリン酸リチウムが溶けにくい溶媒、すなわちジフルオロリン酸リチウムの貧溶媒を加えることにより、ジフルオロリン酸リチウムを析出させて効率的に粉体を回収する方法が考えられた[10]。
脚注
参考文献
関連項目