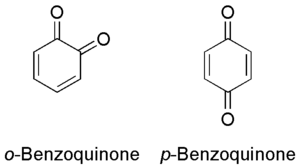
オルト-ベンゾキノン(左)とパラ-ベンゾキノン(右) ベンゾキノン (benzoquinone) とは、分子式 C6 H4 O2 で表される有機化合物 であり、炭素のみで構成された1つの6員環からなるキノン である。2種類の構造異性体 が存在し、1,4-ベンゾキノン(パラ-ベンゾキノン、p -ベンゾキノン、パラ-キノン、just quinone)が一般的であり、1,2-ベンゾキノン(オルト-ベンゾキノン、o -ベンゾキノン、オルト-キノン)は一般的ではない。
純粋な1,4-ベンゾキノンは塩素 に似た特徴的な刺激臭 のする黄色結晶を形成する。純粋でないものは、1,4-ベンゾキノンとヒドロキノン の1:1の混合物であるキンヒドロン が不純物として含まれるため、しばし暗色を呈する。この6員環化合物は、1,4-ヒドロキノンの酸化誘導体として得られる[ 1] ケトン の性質としてオキシム を形成し、酸化剤 の性質として(酸化剤として反応した際に自身は還元されるため)ジヒドロキシ誘導体(1,4-ヒドロキノン)を形成し、アルケン の性質として付加反応 を経てα ,β -不飽和ケトンを形成する。1,4-ベンゾキノンは強い鉱酸 およびアルカリ の両方に対して敏感であり、化合物の縮合 と分解の原因となる。
1,4-ベンゾキノンはアニリン やp -フェニレンジアミン を酸化させることによって得られる[ 2] フェノール をアセトニトリル 溶媒中において過酸化水素 で酸化させることによって、カテコール 、ヒドロキノンとの混合物として得られる[ 3]
1,4-ベンゾキノンは有機合成 において水素アクセプターおよび酸化剤として用いられる[ 4] ディールス・アルダー反応 における親ジエン体としても用いられる[ 5]
ベンゾキノンは無水酢酸 および硫酸 と反応してヒドロキシキノール の3酢酸塩を与え、この反応は1898年にこれを初めて記述したJohannes ThieleにちなんでThiele reactionと呼ばれる[ 6] [ 7]
ベンゾキノンはオレフィン・メタセシス反応 中の二重結合の組み換えを抑制するためにも用いられる。
ヨウ化カリウム の酸性溶液は1,4-ベンゾキノンを1,4-ヒドロキノンに還元させる。また、硝酸銀 水溶液は1,4-ヒドロキノンを1,4-ベンゾキノンに酸化させる。
ポリエステル樹脂 の原料は反応性が高くゲル 化しやすいため、重合禁止剤 としてベンゾキノンが用いられる[ 8] アクリル樹脂 の原料に対しては重合禁止剤としては十分に作用しない[ 2] 酸素 に直接付加することで重合禁止剤として働くと考えられている[ 2]
1,4-ベンゾキノンの誘導体および類似体の例を以下に挙げる。
1,2-ベンゾキノンは、カテコール 水溶液を空気酸化させることによって得られる[ 12] [ 13] フェノール のオルト酸化によっても得られる[ 12] 亜硫酸 などの還元剤と反応させることでカテコールに還元される[ 2] メラニン の前駆体である[ 14] ジエチルエーテル には不溶である。不安定な物質であり合成後1日ほどで分解する[ 2] [ 2]
バクテリア であるPseudomonas mendocina (en )の菌株は安息香酸 の代謝 によってカテコール を介して最終生成物として1,2-ベンゾキノンを得ている[ 13]
^ H. W. Underwood, Jr. and W. L. Walsh (1943). "Quinone" . Organic Syntheses Collective Volume , vol. 2, p. 553^ a b c d e f 化学大辞典編集委員会, ed (1981). 化学大辞典8縮刷版 (第26版 ed.). 共立出版. pp. p.518. ISBN 4320040155
^ 原田幸明 (2008). レアメタルの代替材料とリサイクル . シーエムシー出版. pp. pp.153-154. ISBN 4781300022 ^ Yang, T.-K.; Shen, C.-Y. “1,4-Benzoquinone” in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi :10.1002/047084289 .
^ Oda, M.; Kawase, T.; Okada, T.; Enomoto, T. (1998). "2-Cyclohexene-1,4-dione" . Organic Syntheses Collective Volume , vol. 9, p. 186^ Thiele, Johannes (1898). “Ueber die Einwirkung von Essigsäure-anhydrid auf Chinon und auf Dibenzoylstyrol” . Berichte der deutschen chemischen Gesellschaft (Wiley Online Library) 31 (1): 1247-1249. doi :10.1002/cber.189803101226 . https://doi.org/10.1002/cber.189803101226 . ^ Stereoselective Total Synthesis and Enantioselective Formal Synthesis of the Antineoplastic Sesquiterpene Quinone Metachromin A Wanda P. Almeida, and Carlos Roque D. Correia J. Braz. Chem. Soc., Vol. 10, No. 5, 401–414, 1999 doi :10.1590/S0103-50531999000500011 .^ 前田豊 (2008). 炭素繊維の応用と市場 . シーエムシー出版. pp. p.60. ISBN 9784781300061 ^ E. A. Braude E. A.; Fawcett, J. S. (1963). "1,4-Naphthoquinone" . Organic Syntheses Collective Volume , vol. 4, p. 698^ Vogel, E.; Klug, W.; Breuer, A. (1988). "1,6-Methano[10]annulene" . Organic Syntheses Collective Volume , vol. 6, p. 731^ Harman, R. E. (1963). "Chloro-p-benzoquinone" . Organic Syntheses Collective Volume , vol. 4, p. 148^ a b Magdziak, D., Rodriguez, A. A.; Van De Water, R. W.; Pettus, T. R. R. (2002). “Regioselective oxidation of phenols to o-quinones with o-iodoxybenzoic acid (IBX)” . Org. Lett. 4 (2): 285–288. doi :10.1021/ol017068j . PMC 1557836 . PMID 11796071 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1557836/ .
^ a b Parulekar, Chanda and Mavinkurve, Suneela (2006-02). “Formation of ortho -benzoquinone from sodium benzoate by Pseudomonas mendocina P2 d” . Indian Journal of Experimental Biology (CSIR) 44 (02): 157-162. ISSN 0975-1009 . https://nopr.niscpr.res.in/handle/123456789/6370 .
^ Enzymatic Browning in Fruits, Vegetables and Seafoods Archived 2011年8月22日, at the Wayback Machine .Section 2.3.2
ミイデラゴミムシ - 体内に過酸化水素 とヒドロキノン を貯めておき、これらを反応させ蒸気とベンゾキノンから成る高温の気体を噴射する。