|
三塩化ヒ素
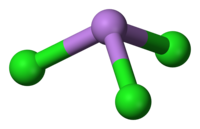
三塩化ヒ素(Arsenic trichloride)は、AsCl3という化学式を持つ無機化合物である。毒性を持つ油状の物質で無色であるが、不純物を含むものは黄色を呈する。有機ヒ素化合物を製造する際の中間体となる[1]。 構造三塩化ヒ素は、C3v対称性を持つピラミッド状の分子である。As-Cl結合は2.161Åの長さで、Cl-As-Clの角は98°25'±30である[2][3]。三塩化ヒ素は、ν1(A1) 416、ν2(A1) 192、ν3 393、ν4(E) 152 cm-1の4つの通常振動モードを持つ[4]。三塩化ヒ素はほぼ共有結合であり、そのため融点は低い。 合成三塩化ヒ素は、三酸化二ヒ素を塩化水素で処理し、その後蒸留することによって製造される。 また、ヒ素を80〜85℃で塩素化することによっても得られるが、この方法には、ヒ素元素が必要である[1]。 酸化ヒ素と一塩化硫黄の反応によっても得られる。この方法は単純な器具しか必要とせず、また効率よく進む[5]。 反応三塩化ヒ素は三塩化リンよりも感湿性が弱いが、それでも湿気を含んだ空気中では気化する[6]。 三酸化二ヒ素で処理することで、無機ポリマーのAsOClを形成する。塩素源の下では、三塩化ヒ素は [AsCl4]-を含む塩を形成する。臭化カリウムやヨウ化カリウムと反応させると、それぞれ三臭化ヒ素や三ヨウ化ヒ素が得られる。有機ヒ素化合物の合成に有益で、三塩化ヒ素からトリフェニルアルシンが合成される[7]。 安全性ヒ素化合物は非常に毒性が高いが、三塩化ヒ素はその揮発性や溶解性のために、特に毒性が高い。 出典
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Index:
pl ar de en es fr it arz nl ja pt ceb sv uk vi war zh ru af ast az bg zh-min-nan bn be ca cs cy da et el eo eu fa gl ko hi hr id he ka la lv lt hu mk ms min no nn ce uz kk ro simple sk sl sr sh fi ta tt th tg azb tr ur zh-yue hy my ace als am an hyw ban bjn map-bms ba be-tarask bcl bpy bar bs br cv nv eml hif fo fy ga gd gu hak ha hsb io ig ilo ia ie os is jv kn ht ku ckb ky mrj lb lij li lmo mai mg ml zh-classical mr xmf mzn cdo mn nap new ne frr oc mhr or as pa pnb ps pms nds crh qu sa sah sco sq scn si sd szl su sw tl shn te bug vec vo wa wuu yi yo diq bat-smg zu lad kbd ang smn ab roa-rup frp arc gn av ay bh bi bo bxr cbk-zam co za dag ary se pdc dv dsb myv ext fur gv gag inh ki glk gan guw xal haw rw kbp pam csb kw km kv koi kg gom ks gcr lo lbe ltg lez nia ln jbo lg mt mi tw mwl mdf mnw nqo fj nah na nds-nl nrm nov om pi pag pap pfl pcd krc kaa ksh rm rue sm sat sc trv stq nso sn cu so srn kab roa-tara tet tpi to chr tum tk tyv udm ug vep fiu-vro vls wo xh zea ty ak bm ch ny ee ff got iu ik kl mad cr pih ami pwn pnt dz rmy rn sg st tn ss ti din chy ts kcg ve