|
Benzols
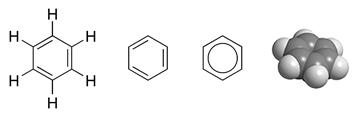
Benzols (fenilūdeņradis, C6H6) parastos apstākļos ir bezkrāsains degtspējīgs šķidrums ar saldenu smaržu. Tā molekula sastāv no 6 oglekļa atomiem, kas ir savienoti gredzenā un katram no šīem oglekļiem ir pievienots viens ūdeņradis. Benzols ir vienkāršākais arēns jeb aromātiskais ogļūdeņradis. To plaši izmanto rūpniecībā, tā ir izejviela zāļu, dažādu plastmasu, sintētiskās gumijas, krāsvielu ražošanā. Benzols ietilpst jēlnaftas sastāvā, tomēr rūpnieciski to iegūst sintētiski no citiem naftas komponentiem. Benzols ir toksisks un kancerogēns savienojums. Tas ir arī kaitīgs apkārtējai videi un ugunsbīstams (tvaiki aizdegas −11 °C temperatūrā, patvaļīgi benzols aizdegas 561 °C temperatūrā). ĪpašībasBenzols ir ūdenī mazšķīstošs savienojums (šķīdība ir 1,79 g/l 25 °C temperatūrā), kas toties veido ar ūdeni azeotropu maisījumu (tā viršanas temperatūra ir 69,25 °C, benzola saturs masas procentos ir 91%[1]). Tīra benzola stigrība ir 0,652 puāzi 20 °C temperatūrā. Benzolam ir mazāka reaģētspēja nekā aizvietotajiem arēniem. Visas saites starp oglekļa atomiem benzolā ir vienāda garuma (140 pm). Tās ir īsākas par vienkāršajām saitēm (147 pm) un garākas par dubultsaitēm (134pm). Benzola molekulā π orbitāles elektroni ir vienmērīgi izkliedēti starp visiem 6 oglekļa atomiem, tāpēc benzola struktūrformulu dažreiz zīmē kā sešstūri ar ievilktu apli. Aizvietotajiem aromātiskajiem ogļūdeņražiem tas vairs pilnībā nav spēkā un π orbitāles elektronu sadalījums vairs nav vienmērīgs. Aizvietojot benzola molekulā vienu vai vairākus ūdeņraža atomus ar funkcionālajām grupām, var iegūt citus arēnus:
IzmantošanaBenzolam ir relatīvi liels oktānskaitlis, tāpēc agrāk to lietoja kā degvielas komponentu, taču benzols ir kancerogēns, tāpēc to degvielām vairs nelieto (legāli). Gan Eiropā, gan ASV benzolu izmanto citu ķimikāliju ieguvei, piemēram, etilbenzola, kumola vai cikloheksāna. Skatīt arīAtsauces
Ārējās saites
|
||||||||||||||||||||||||||||