|
Селеноводород
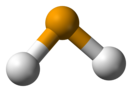
Селеноводоро́д (села́н, селени́д водоро́да, химическая формула — H2Se) — неорганическое бинарное соединение водорода и селена. При стандартных условиях, селеноводород — это бесцветный тяжёлый газ. Горюч, очень ядовит, имеет резкий отвратительный запах. Самое токсичное соединение селена с опасным периодом воздействия 0,3 ppm в вдыхаемом воздухе за 8 часов. СтруктураМолекула селеноводорода имеет «изогнутую» структуру H—Se—H с валентным углом 91°. Наблюдается три колебательные полосы в инфракрасном спектре: 2358, 2345 и 1034 см−1. Физические свойстваПри нормальных условиях селеноводород является тяжёлым бесцветным газом; плотность 3,310 кг/м3, почти втрое тяжелее воздуха. При повышении давления до 9,5 ± 0,1 атм сжижается при комнатной температуре. При нормальном давлении температура кипения равна −41,25 °C, температура плавления −65,73 °C. Химические свойстваХимические свойства селеноводорода схожи со свойствами сероводорода, хотя H2Se обладает большей кислотностью (pKa = 3,89 при 25 °C), чем H2S (pKa = 11,0 при 25 °C). Имея более высокую кислотность, селеноводород лучше растворим в воде. Поскольку селеноводородная кислота (раствор селеноводорода в воде) является двухосновной кислотой, она обладает второй константой кислотности, соответствующей полной диссоциации; она равна pKa2 = 15,05 ± 0,02 при 25 °C[3]. Селеноводородная кислота образует с металлами соли — селениды, например селенид натрия Na2Se. При горении селеноводорода в воздухе или кислороде образуется диоксид селена и вода: При недостатке кислорода и пониженной температуре окисляется до элементарного селена[4]: ПолучениеДля получения селеноводорода могут использоваться реакции взаимодействия селенидов активных металлов с водой или разбавленными кислотами, например гидролиз селенида алюминия Al2Se3, сопровождающийся образованием гидроксида алюминия: Селеноводород образуется также в результате взаимодействия с кислотой селенида железа(II) FeSe: Также может быть получен прямым синтезом их элементов при нагреве свыше 400 °С[5]: ПрименениеH2Se используется в органическом синтезе для получения селеноуратов из нитрилов в реакциях присоединения по тройной углеродной связи[6]: Также H2Se применяется в полупроводниковой промышленности для газофазного легирования полупроводников типа III—V (например, арсенида галлия) с целью придания им электронного типа проводимости. ТоксичностьСеленоводород чрезвычайно ядовит и считается наиболее ядовитым соединением селена[7] и намного более токсичен, чем сероводород. Однако он имеет настолько отвратительный запах, что случайно отравиться человеку им невозможно: порог ощущения запаха в воздухе 0,05 объёмных частей на миллион (ppm). При концентрации 0,3 ppm газ начинает раздражающе действовать на органы дыхания, а свыше концентрации 1,5 ppm запах становится совершенно невыносимым. Несмотря на очень высокую токсичность, смертельные случаи отравления им неизвестны. Воздействие более высоких концентраций менее чем за минуту вызывает поражение органов дыхания с симптомами, сходными с симптомами простуды, продолжающимися несколько дней после однократного воздействия. Предельно допустимая концентрация селеноводорода в воздухе производственных помещений 0,2 мг/м³[8][9]. Объёмная концентрация 1 ppm в воздухе соответствует массовой концентрации 3,31 мг/м³. Примечания
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||