|
Пірролізин
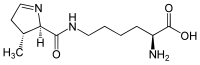
Пірролізин (аббр. Pyl або O) неканонічна альфа-амінокислота яка використовується деякими метаногенними бактеріями та археями при біосинтезі білків;[1][2] не використовується при біосинтезі білків еукаріотами. Пірролізин кодується кодоном UAG, який зазвичай виконує роль стоп-кодона (амбер-кодон). Бічний ланцюг пірролізина нагадує лізин та є катіоном за фізіологічних значень pH. Пірролізин як 22-га протеїногенна амінокислотаМайже всі протеїни в земних живих істотах синтезуються тільки з 20 стандартних, або канонічних амінокислот. Ця двадцятка доповнюється двома неканонічними амінокислотами (селеноцистеїн та пірролізин), які також можуть вбудовуватись в білки трансляційною машинерією деяких типів клітин. Пірролізин був відкритий у 2002 році в активному сайті ензима монометиламін метилтрансферази (MtmB) з метан-продукуючої археї Methanosarcina barkeri.[3][4] Пізніше були знайдені ще чотири види архей (Methanosarcina acetivorans, Methanosarcina mazei, Methanosarcina thermophila, Methanococcoides burtoni) та один вид Грам-позитивних бактерій (Desulfitobacterium hafniense) які можуть використовувати пірролізин в біосинтезі білків.[5] В матричній РНК пірролізин кодується кодоном UAG який в інших організмах зазвичай є стоп-кодоном. Спеціальна аміноацил-тРНК-синтетаза ацилює пірролізином додаткову транспортну РНК з антикодоном CUA, внаслідок чого при трансляції мРНК на рибосомі відбувається встроювання пірролізину в поліпептидний ланцюг.[3][5] Біосентетична машинерія необхідна для біосинтезу пірролізину та пірролізин-вмісних білків кодується в кластері генів pylTSBCD,[6] який також називають пірролізиновим опероном (англ. Pyl operon).[5] Гени pylT та pylS розташовані на початку оперону кодують пірролізинову тРНК та пірролізинову аміноацил-тРНК-синтетазу, відповідно. Гени pylB, pylC та pylD кодують ензими необхідні для біосинтезу пірролізину з лізину.[5] При цьому лише гени pylT та pylS є критично необхідними для функціонування цієї розширеної версії генетичного коду. Так, було показано, що при переносі генів pylT та pylS в інші бактерії (зокрема в E.coli) вони можуть вбудовувати пірролізин в білки у відповідь на UAG-кодон, за умови якщо готовий синтетичний пірролізин додається до поживного середовища.[7] Каталітична функціяДодаткове гетероциклічне кільце пірролізину зазвичай використовується в активних сайтах деяких метилтрансфераз. Вважається, що це кільце може відносно вільно обертатись. Вважається, що воно бере участь у правильній орієнтації метильної групи метиламіну для взаємодії з корріноїдним кофактором.[4] Генетичне кодуванняПринциповою відмінністю пірролізину від інших неканонічних амінокислот, таких як, наприклад, гідроксилізин, є те що пірролізин вбудовується в білки на стадії трансляції, тоді як інші аналоги лізину та інших амінокислот виникають внаслідок пост-трансляційних перетворень. Позиція пірролізину в поліпептиді керується генетичним кодом, так само як і для канонічних амінокислот. Пірролізин кодується в мРНК кодоном UAG, який у більшості організмів є одним із стоп-кодонів (амбер стоп-кодон). Для цього процесу необхідний ген pylT, який кодує додаткову транспортну РНК (тРНК) з CUA антикодоном, а також гену pylS, який кодує додаткову аміноацил-тРНК-синтетазу, яка прикріплює пірролізин до його тРНК. Ця нова тРНК-ааРС пара («ортогональна пара») діє незалежно від пар, що відповідають іншим амінокислотам. На основі цієї ортогонально пари були розроблені методи високоточного селективного введення нестандартних хімічних модифікацій в рекомбінантні білки при їх експресії в Escherichia coli або в інших системах.[8][9] Примітки
|
||||||||||||||||||||||||||||||