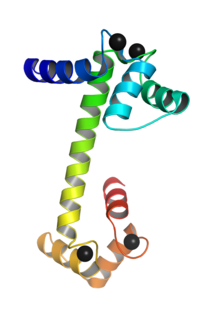
钙调素的三维结构,所结合的四个钙离子用黑球来表示。 钙调蛋白 (英語:Calmodulin ,简称CaM),又稱為攜鈣素 ,是一種能与钙离子结合的蛋白质 ,普遍存在真核生物 细胞 中。
钙调蛋白是一种多功能中介钙结合蛋白。[ 1] 第二信使
Ca
2
+
{\displaystyle {\ce {Ca^2+}}}
Ca
2
+
{\displaystyle {\ce {Ca^2+}}}
Ca
2
+
{\displaystyle {\ce {Ca^2+}}}
激酶 或磷酸酶 等目标蛋白的活性而起到信号转导的作用。[ 2] [ 3]
钙调蛋白由148个氨基酸 组成(分子量 为16700Da ),其氨基酸序列高度保守;含有大量酸性氨基酸(有1/3是谷氨酸 和天冬氨酸 ),为酸性蛋白质(等电点 为4.3)。[ 4] 结构域 ,中间由一个柔性连接区域连接,每一个结构域都有一对EF手 模体 ,总共含有4个EF手模体,每一个EF手结构模体都有一个钙离子结合位点。钙调蛋白通过四个钙离子结合位点与
Ca
2
+
{\displaystyle {\ce {Ca^2+}}}
Ca
2
+
{\displaystyle {\ce {Ca^2+}}}
钙离子结合区在氨基酸序列中的位置是:21 - 32、57 - 68、94 - 105和130 -141(从N端到C端);钙结合的每个区域都有12个氨基酸残基的长度。这些区域位于两个α-螺旋 结构之间,前两个区域(21 - 32和57 - 68)位于链接区域的一边。[ 5]
钙调蛋白的靶蛋白种类繁多,这要求钙调蛋白的结构具有一定的特点。其特点可以概括为如下两方面:
一、钙调蛋白的结构具有高度可变性(Flexibility)。通过比对自由状态下的钙调蛋白的结构与结合到靶蛋白上的钙调蛋白的结构,可以很容易发现钙调蛋白结构的可变性。但核磁共振 技术的研究表明即使在自由状态下,钙调蛋白的柔性连接区域也表现出动态构象。简而言之,钙调蛋白的连接区域是天然无折叠蛋白片段(Intrinsic Disordered Proteins)。
二、钙调蛋白非极性结合位点的口袋形状具有通用性,它不需要靶蛋白具有特定的氨基酸序列。[ 5]
一个例子是钙调蛋白既能与钾离子通道蛋白 结合,又能与N-甲基-D-天冬氨酸受体蛋白 (NMDA受体)结合。它们的氨基酸序列相差较大,仅长度就相差50个氨基酸残基。[ 6] [ 7]
钙离子结合之前与之后,钙调蛋白结构的比较。图像来源于PDB。 EF手结构域为
Ca
2
+
{\displaystyle {\ce {Ca^2+}}}
甲硫氨酸 残基的疏水性甲基 通过构象变化暴露在钙调蛋白表面,让钙调蛋白表面更具有疏水性质。此后钙调蛋白可以与目标蛋白上的碱性的两亲性螺旋(BAA螺旋)结合。这些螺旋含有互补的疏水区域。钙调蛋白的柔性连接区域允许钙调蛋白的两个亚基紧密环绕它的靶蛋白。[ 5]
C-末端结构域(CTD)在溶液中的结构与x射线解析得到的晶体结构相似,而N-末端结构域(NTD)相对于晶体状态,其EF手模体的开放程度大大降低。这表明
Ca
2
+
{\displaystyle {\ce {Ca^2+}}}
别构效应 。
钙调蛋白本身是
Ca
2
+
{\displaystyle {\ce {Ca^2+}}}
细胞质中的钙离子浓度低至
10
−
7
M
{\displaystyle 10^{-7}M}
希尔方程 (Hill Equation)进行描述。借由协同效应,钙调蛋白能够对微量钙离子浓度的变化进行快速响应。钙调蛋白只有在与钙离子结合之后才能够处于开放状态,具有生物活性,因此钙调蛋白的活性可以看成细胞质钙离子水平的一个标度。
钙调蛋白主要通过调节靶酶活性的方式调节细胞的代谢过程。CaM-Ca2+复合体是一些酶(主要是激酶和磷酸酶)的辅酶 ,对于它们发挥功能是必要的。有研究表明CaM-Ca2+还可以与钾离子通道蛋白、一些细胞膜上的受体相互作用[ 6] [ 7]
(文献来源请求)
钙调蛋白可以与很多不同的蛋白质结合,因此影响了细胞功能的方方面面。钙调素参与介导的生命活动进程有炎症反应 、代谢 、细胞凋亡 、肌肉收缩 、细胞内运动、短期 和长期记忆 、神经 生长以及免疫反应 等。一些研究者还发现,钙调素可以在细胞核 内发挥功能,其可能参与前mRNA 的剪切和调控核糖体 聚合及功能发挥。[ 8] 信号传导 体系中作为重要的第二信使 ,所以这些钙调素结合蛋白就可以利用钙调素来作为钙感应器和信号传导分子。[ 9] 转录 以及翻译后修饰 (如磷酸化 、乙酰化 、甲酰化 和蛋白酶解)所调控。[ 10]
^ Stevens, F. C. Calmodulin: an introduction . Canadian Journal of Biochemistry and Cell Biology = Revue Canadienne De Biochimie Et Biologie Cellulaire. August 1983, 61 (8): 906–910 [2017-11-18 ] . ISSN 0714-7511 PMID 6313166 原始内容 存档于2017-12-01). ^ Chin, D.; Means, A. R. Calmodulin: a prototypical calcium sensor . Trends in Cell Biology. August 2000, 10 (8): 322–328 [2017-11-18 ] . ISSN 0962-8924 PMID 10884684 原始内容 存档于2017-12-08). ^ Dale., Purves,. Neuroscience. 5th ed. Sunderland, Mass.: Sinauer Associates https://web.archive.org/web/20190701170043/https://www.worldcat.org/title/neuroscience/oclc/754389847 . 2012 [2017-11-18 ] . ISBN 9780878936953OCLC 754389847 原始内容 存档于2019-07-01). ^ 《中国大百科全书 》光盘版:生物学,钙调素
^ 5.0 5.1 5.2 Goodsell, D.S. Calmodulin . RCSB Protein Data Bank. [2017-11-18 ] . doi:10.2210/rcsb_pdb/mom_2003_8 原始内容 存档于2021-04-13). ^ 6.0 6.1 Ataman, Z.A.; Gakhar, L. ; Sorensen, B.R.; Hell, J.W., Shea, M.A. Crystal Structure of Ca2+/Calmodulin bound to NMDA Receptor NR1C1 peptide . 2007-11-13 [2017-11-18 ] . (原始内容 存档于2017-12-01). ^ 7.0 7.1 Zhang, M., Pascal, J.M., Logothetis, D.E., Zhang, J.F. Calcium-calmodulin (T79D) complexed with the calmodulin binding domain from a small conductance potassium channel SK2-a . 2014-08-06 [2017-11-18 ] . (原始内容 存档于2016-03-15). ^ (英文) Agell, N.; et al. New nuclear functions for calmodulin. Cell Calcium. 1998, 23 (2-3): 115–121. PMID 9601606 ^ (英文) Chin, D. and Means, A. R. Calmodulin: a prototypical calcium sensor. Trends Cell Biol. 2000, 10 (8): 322–328. PMID 10884684 ^ (英文) Kortvely, E. and Gulya, K. Calmodulin, and various ways to regulate its activity. Life Sci. 2004, 74 (9): 1065–1070. PMID 14687647