|
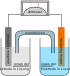
Dual-Carbon-AkkumulatorDer Dual-Carbon-Akkumulator, auch Dual-Ion-Akkumulator genannt, ist eine Akkumulator-Variante, die mit dem Lithiumakkumulator verwandt ist. Allerdings bestehen als Besonderheit beide Elektroden, sowohl die Kathode als auch die Anode, aus porösem Graphit. Erste Entwicklungen zu diesem Akkumulator gehen auf Arbeiten Anfang der 1970er Jahr bei der United States Navy zurück, es folgten in den späten 1980er Jahren Arbeiten bei dem Chemieunternehmen Dow Chemical.[1][2] Es gab wiederholt Versuche, diesen Akkumulatortyp kommerziell zu verwerten, unter anderem im Jahr 2014 von der japanischen Firma Power Japan Plus für die geplante Anwendungen bei Elektroautos.[3] Mit Stand 2020 erlangte dieser Akkumulatortyp bisher keine nennenswerte wirtschaftliche Bedeutung. FunktionsweiseDer Elektrolyt zwischen den Elektroden wird aus Lithiumhexafluorophosphat (LiPF6), einem Salz von Lithium, gebildet und wird in einem nicht direkt am elektrochemischen Vorgang beteiligten wasserfreien Lösungsmittel wie Dimethylsulfit oder Propylencarbonat gelöst.[2][4] Bei ungeladenen Akkumulator liegen die positiven Ionen (Li+) des Lithiumsalzes in der Lösung vor, bei Ladung werden sie in der negativen Graphitelektrode (Anode) eingelagert und bilden dort LiC6. An der positiven Elektrode werden die negativen Anionen des Salzes (PF6−) eingelagert. Bei der Entladung dreht sich dieser Vorgang um und die Lithiumionen und Anionen gehen in die Salzlösung über. An der positiven Elektrode läuft dabei bei Ladung folgender elektrochemischer Vorgang ab: und an der negativen Elektrode bei Ladung:
Als Gesamtreaktion des Ladens ergibt sich:
Bei der Entladung drehen sich die Pfeilrichtungen um. Wie man erkennt, wird während des Ladens die Konzentration des Salzes im Elektrolyten verringert. Um zu vermeiden, dass die Leitfähigkeit der Lösung zu klein wird, wird daher ein Überschuss an Elektrolytsalz verwendet. Einzelnachweise
Information related to Dual-Carbon-Akkumulator |