| Hidrazin
|
 |
|

|
| IUPAC-név |
Hidrazin
|
| Szabályos név |
Diazán[1]
|
| Kémiai azonosítók
|
| CAS-szám |
302-01-2
|
| EINECS-szám |
206-114-9
|
| RTECS szám |
MU7175000
|
| Kémiai és fizikai tulajdonságok
|
| Kémiai képlet |
N2H4
|
| Moláris tömeg |
32,05 g/mol
|
| Megjelenés |
Színtelen folyadék
|
| Sűrűség |
1,00 g/cm³ (folyadék, 25 °C-on)
|
| Olvadáspont |
2,0 °C
|
| Forráspont |
113,5 °C
|
| Oldhatóság (vízben) |
korlátlanul elegyedik
|
| Savasság (pKa) |
8,1
|
| Kristályszerkezet
|
| Dipólusmomentum |
1,85 D
|
| Termokémia
|
Std. képződési
entalpia ΔfHo298 |
50,6 kJ/mol
|
Égés standard-
entalpiája ΔcHo298 |
621,5 kJ/mol
|
Standard moláris
entrópia So298 |
121,2 J/mol·K
|
| Veszélyek
|
| EU osztályozás |
Mérgező (T)
Veszélyes a környezetre (N)[2]
|
| NFPA 704 |
|
| R mondatok |
R10, R23/24/25, R34, R43, R45, R50/53[2]
|
| S mondatok |
S45, S53, S60, S61 [2]
|
| Robbanási határ |
1.8–100%
|
| Rokon vegyületek
|
| Rokon nitrogén-hidridek |
Ammónia
Hidrogén-azid
|
| Rokon vegyületek |
Monometil-hidrazin
Dimetil-hidrazin
Fenil-hidrazin
|
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak.
|
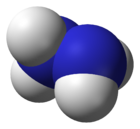
A hidrazin a nitrogén és hidrogén N2H4 összegképletű vegyülete, szerkezete H2N–NH2. Említik még diamin néven is. A vízmentes hidrazin levegőn füstölgő, ammóniához hasonló, 70-80 ppm koncentrációnál már észlelhető szagú folyadék. Vízzel és alkoholokkal korlátlanul elegyedik.
Neve a görög hydór (ύδωρ = víz) és a francia azote (nitrogén) összetételéből származik.[3]
Előfordulás
A természetben nem található.
Előállítása
A hidrazint először Theodor Curtius állította elő 1887-ben. Raschig 1907-ben bevezetett eljárása szerint ammónia lúgos nátrium-hipoklorit oldattal történő reakciójával állítják elő, zselatin vagy enyv (mint komplexképzők) jelenlétében:


A komplexképzők célja a nehézfémionok, például CuII eltávolítása, melyek katalizálnák a hidrazin és klóramin közötti mellékreakciót. Az oldatból a hidrazin-hidrát (H2N–NH2·H2O) – egy olajszerű folyadék – ledesztillálható, szilárd nátrium-hidroxid (NaOH) hosszas hevítés hatására a hidrát vizét elvonja.
Fizikai és kémiai tulajdonságai
Cseppfolyós állapotban – a folyékony ammóniához hasonlóan – számos szervetlen sót jól old. Jó redukálószer, az ammóniás réz(II)-klorid oldatot elszínteleníti, nemesfémsókat fémmé redukál. Vizes oldatban az ammóniánál valamivel gyengébb bázis, savakkal egy és kétbázisú sókat képez.
A hidrazin bár pozitív képződéshőjű vegyület, szobahőmérsékleten tiszta állapotban vagy vizes oldatban stabil. Magasabb hőmérsékleten azonban könnyen – akár robbanásszerűen – bomlik:

Levegőn meggyújtva is jelentős hőfejlődés közben ég el:

Híg vizes oldatból történő meghatározása redukáló képességén alapul:

A végpontot a jód színének a szerves fázisból való eltűnése jelzi.
Felhasználás
- Atomerőművi vízkezelő anyag (nyomott vizes reaktor típusnál)
- Rakéta-hajtóanyagként (UDMH:aszimmetrikus dimetil-hidrazin)
- Laboratóriumi vegyszerként (erős redukálószer)
- Nagynyomású kazánok vizének kezelésére (oxigénmentesítés)
- Biológiailag aktív anyagok, színezékek és más szerves vegyületek előállítására
Élettani hatások
- Rákkeltő
- Maró hatású
- Belélegezve égő érzés, köhögés, fejfájás, hányinger, légszomj, torokfájás, görcsök jelentkezhetnek
- Bőrön keresztül is felszívódhat, vörösséget, bőrégést okoz
- Szembe jutva súlyos, mély égést okoz
- Lenyelve hasi görcsök, zavartság, eszméletlenség, hányás, gyengeség jelentkezik
Jegyzetek
Források
N. N. Greenwood, A. Earnshaw: Az elemek kémiája, Nemzeti Tankönyvkiadó, Budapest, 1999. ISBN 963-18-9144-5
Römpp vegyészeti lexikon F-K, Műszaki Könyvkiadó, Budapest, 1982. ISBN 963-10-3269-8








