|
Nitrogén
A nitrogén a periódusos rendszer V.A csoportjába tartozó nemfémes elemek egyike. Rendszáma 7, vegyjele N. Vegyértékelektron-szerkezete 2s22p3. A nitrogén elemi állapotban színtelen, szagtalan, íztelen, kevéssé reakcióképes kétatomos gáz. A Föld légkörének 78,09 térfogatszázalékát alkotja. A nitrogént 1772-ben fedezte fel Daniel Rutherford skót orvos, mikor rájött, hogy a levegőből elkülöníthető. A nitrogén az univerzumban gyakran előforduló elem, becslések szerint a galaxisunkban és a Naprendszerben a hetedik leggyakoribb elem. A szupernóvákban szén és hidrogén fúziójával szintetizálódik. Az elemi nitrogén, illetve a hidrogénnel és oxigénnel alkotott vegyületei illékonyságuk miatt sokkal kevésbé gyakoriak a Naprendszer belső kőzetbolygóin; egészében véve a nitrogén viszonylag ritka elem a Föld kérgében. Azonban – mint a Földön – a nitrogén és vegyületei gázhalmazállapotban gyakran előfordulnak a légkörrel rendelkező bolygók és holdak atmoszférájában. Számos iparilag fontos vegyület, mint például az ammónia, a salétromsav, a szerves nitrátok (hajtógázok és robbanóanyagok), és a cianidok is tartalmaznak nitrogént. Az elemi nitrogénben lévő rendkívül erős kötés meghatározó jelleggel bír; nehézséget okoz az organizmusoknak és az iparnak egyaránt, hogy a N2 gázt hasznos vegyületekké alakítsa, ugyanakkor gyakran hasznos, nagy mennyiségű energia szabadul fel, amikor ezek a vegyületek elégnek, felrobbannak, vagy nitrogéngázra bomlanak vissza. A szintetikusan előállított ammónia és nitrátok kulcsfontosságú ipari műtrágyák; azonban ezek egyben a legfőbb szennyező anyagok is, melyek a vizek eutrofizációját okozzák. A legfőbb felhasználási területeken kívül a nitrogénvegyületek sokoldalú szerves anyagok. A nitrogén alkotóeleme olyan változatos anyagoknak, mint a kevlár szövet és cianoakrilát ragasztó. A nitrogén összetevője minden nagyobb farmakológiai gyógyszer osztály – beleértve az antibiotikumok – molekuláinak is. Számos készítmény elő-gyógyszere, vagy imitációja a természetes nitrogéntartalmú jelző molekuláknak: például a szerves nitrátok közé tartozó nitroglicerin és a nitroprusszid képes a vérnyomás kontrollálására, mert azok metabolitja a természetes nitrogén-monoxid. A növényi alkaloidok (gyakran a növény védelmére szolgáló vegyületek) is tartalmaznak nitrogént, így sok jelentős nitrogéntartalmú gyógyszer – mint például a koffein és a morfin – hatással van az állati neurotranszmitterek receptoraira. Nitrogén előfordul minden élő szervezetben, elsősorban az aminosavakban (és így fehérjékben), valamint a nukleinsavakban (DNS és RNS). Az emberi test mintegy 3 tömegszázalék nitrogént tartalmaz, ezzel az oxigén, a szén és a hidrogén után a negyedik leggyakoribb elem az emberi testben. Az elem mozgását a levegőből a bioszférába és a szerves vegyületekbe, majd onnan vissza a légkörbe a nitrogénciklus írja le. Története és etimológiája Régi magyar neve: légeny[4] vagy azót.[5] A nitrogént hivatalosan Daniel Rutherford skót orvos fedezte fel 1772-ben, aki „kártékony levegőnek” (noxious air) vagy „rögzített levegőnek” (fixed air) nevezte azt.[6][7] Rutherford számára ismert volt az a tény, hogy a levegő olyan összetevője, amely nem táplálja az égést. Körülbelül ugyanabban az időben Carl Wilhelm Scheele, Henry Cavendish, és Joseph Priestley is vizsgálta nitrogént; ők „megégett levegőként” vagy „flogisztikálódott levegőként” utaltak rá. A nitrogéngáz eléggé közömbös volt, belélegezvén az állatok elpusztultak, és a tűz kialudt benne; így Antoine Lavoisier úgy hivatkozott rá, mint „fojtó levegő” illetve „azote”; a görög ἄζωτος (azotos) szó után, melynek jelentése élettelen.[8] Lavoisier kifejezése a nitrogénre széles körben elterjedt; Magyarországon az „azotum”, „azót” kifejezésekkel illették, olyan szavak mellett, mint a „fojtós matéria, „fojtószer” és „fullasztó”.[4] A nyelvújítás idején, a magyar kémiai műnyelv létrehozására irányuló erőltetett törekvések vezettek a „légeny” szó megszületéséhez; ám ez sok más szóval egyetemben nem honosodott meg, a tudomány képviselői idővel visszatértek a nemzetközi kifejezésekre.[4] A ma is használatos nitrogén elnevezés a francia nitrogène szóból származik, amelyet 1790-ben alkotott meg Jean-Antoine Chaptal (1756–1832) francia kémikus, a görög nitron (nátrium-karbonát) és a francia gène (termelő) szavakból. A nitrogént megtalálták a salétromsavban; Chaptal felfogása szerint a nitrogéngáz a salétromsav alapvető része volt.[9] (A salétromsav salétromból (kálium-nitrát) származtatható, melynek régebbi elnevezését (nitre) nátrium vegyületekre is használták).[forrás?] A nitrogén vegyületei már a középkorban is jól ismertek voltak. Az alkimisták a salétromsavat aqua fortis (erős víz) néven ismerték. A salétromsav és a sósav elegyének neve aqua regia (királyvíz) volt, mert arról volt híres, hogy feloldotta az aranyat (a fémek királyát). A legkorábban katonai, ipari, és mezőgazdasági célokra felhasznált nitrogénvegyület a salétrom volt (nátrium-nitrát és kálium-nitrát), elsősorban puskaporként, majd műtrágyaként hasznosították. 1910-ben John William Strutt felfedezte, hogy egy elektromos kisülés a nitrogéngázban „sárga fényben ragyogó, örvénylő felhő” formájában „aktív nitrogént” eredményez, amely egy egyatomos allotrop módosulatnak tekinthető. Az aktív nitrogén reagált a higannyal, robbanásveszélyes higany-nitridet alkotva.[10] ElőállításaA nitrogéngáz ipari gáz, amelyet cseppfolyós levegőből frakcionált desztillációval vagy gáz-halmazállapotú levegőből mechanikus úton állítanak elő (pl. túlnyomásos fordított ozmózisos membrán vagy nyomásadszorpció (pressure swing adsorption) révén). A kereskedelmi nitrogén gyakran az acélgyártáshoz szükséges oxigénkoncentrációt megteremtő iparilevegő-feldolgozás mellékterméke. Palackba sűrítve gyakran nevezik OFN-nek (oxigénmentes nitrogén).[11] Laboratóriumi körülmények között előállítható például ammónium-nitrit hevítésével,[forrás?] vagy ammónium-klorid vizes oldatának és nátrium-nitrit reakciójával.[12] Ez utóbbi reakcióban kis mennyiségben NO- és HNO3-szennyeződés is keletkezik. A szennyeződések eltávolíthatók, ha a gázt kálium-dikromát-tartalmú vizes kénsavoldaton vezetik át.[12] Nagyon tiszta nitrogén állítható elő bárium-azid vagy nátrium-azid termikus bontásával.[13] Tulajdonságai A nitrogén nagy elektronegativitású (3,04)[14] nemfémes elem. Vegyértékhéján öt elektron található, ennek következtében a legtöbb vegyületében három vegyértékű. Molekulája kétatomos (N2), benne háromszoros kovalens kötés van, melyből egy szigma-kötés és kettő pi-kötés. Ez a hármas kötés az egyik legerősebb. Nem táplálja az égést. Ennek a kötésnek az erőssége meghatározó a természeti és az emberi gazdasági tevékenységek szempontjából, mert megnehezíti a nitrogéngáz más vegyületekké alakítását, de megkönnyíti azok ismételt N2 gázzá alakítását (ez nagy energiafelszabadulással jár). Légköri nyomáson a molekuláris nitrogén forráspontja 77 K (−195,79 °C); olvadáspontja pedig 63 K (−210,01 °C);[15] szilárd halmazállapotban allotrop kristályszerkezete béta hexagonális. 35,4 K (−237,6 °C) alatt a nitrogén köbös kristályszerkezetű allotrop módosulatként van jelen (úgynevezett alfa-fázis).[16] A cseppfolyós nitrogén egy a vízhez hasonló megjelenésű folyadék, ismert kriogén anyag; sűrűsége a vízének 80,8 százaléka (a folyékony nitrogén sűrűsége a forrásponti hőmérsékleten 0,808 g/ml).[17] A nitrogén kettőnél több atomot tartalmazó allotrop módosulatait, mint például az N3 és N4, laboratóriumban sikerült előállítani.[18] Rendkívül magas nyomáson (1,1·106 atm) és magas hőmérsékleten (2000 K) a nitrogén egyszeres kötésű, szinklinális (gauche) köbös kristályszerkezetű anyaggá polimerizálódik. (Ilyen körülményeket gyémánt üllővel lehet előállítani). Ez a struktúra nagyon hasonló a gyémántéhoz, mindkettő rendkívül erős kovalens kötéseket tartalmaz; ezért az N4 beceneve a „nitrogén gyémánt”.[19] Egyéb (még nem szintetizált) allotrópjai közé tartozik a hexazin (N6, a benzolgyűrű analogonja),[20] és az oktaazakubán (N8, a kubán analogonja).[21] Az előbbiről azt feltételezik, hogy rendkívül instabil; míg az utóbbi az előrejelzések szerint kinetikailag stabil, a molekula szimmetriájából adódóan.[22] Izotópjai A nitrogénnek két stabil izotópja létezik: 14N és 15N. Messze a leggyakoribb a nitrogén-14 (99,634 %), amely a csillagokban termelődik a CNO-ciklus során. A tíz szintetizált izotóp közül a 13N felezési ideje durván tíz perc, míg a többi nem-stabil izotópé másodperc nagyságrendű.[23] A biológiailag közvetített reakciók (pl. asszimiláció, nitrifikáció és denitrifikáció) határozott ellenőrzés alatt tartják a talaj nitrogéndinamikáját. Ezek a reakciók általában a talaj 15N-dúsulását és a termékek kimerülését eredményezik.[24] A Föld légkörében lévő molekuláris nitrogén egy kis része (0,73 %) a 14N15N izotopológ (ez tehát két különböző nuklidot tartalmazó nitrogénmolekula); míg a fennmaradó rész szinte teljes egészében 14N2.[25] A 16N radioizotóp a domináns radionuklid a nyomottvizes, illetve a forralóvizes reaktorok hűtőfolyadékában, azok normál működése esetén. A vízben lévő oxigén-16-ból keletkezik (n,p) reakció révén. Rövid, körülbelül 7,1 másodperces felezési ideje van,[23] de miközben oxigén-16-tá bomlik vissza, nagy energiájú (5–7 MeV) gamma-sugárzást bocsát ki.[23][26] Emiatt a nyomottvizes reaktor primer hűtőközegének hozzáférhetőségét a reaktor működése alatt korlátozni kell. A nitrogén-16 az egyik legfontosabb alkalmazott eszköz, amellyel a primer hűtőkör szekunder gőzkörbe való csekély szivárgását is azonnal észlelni lehet.[26] Hasonlóképpen korlátozni kell működés közben a forralóvizes reaktorú atomerőmű gőzköreinek bármelyikének összetevőihez való hozzáférést. A kondenzátorból származó kondenzátumot általában tíz percig állni hagyják, hogy lehetővé tegyék a nitrogén-16 elbomlását. Ez szükségtelenné teszi a tápvíz csővezetékek és szivattyúk leárnyékolását, és a hozzáférésük korlátozását.[forrás?] Elektromágneses spektruma A molekuláris nitrogén (14N2) nagy mértékben átlátszó az infravörös és látható tartománybeli sugárzás számára, mivel a dipólusmomentuma nulla, és így nem tud kölcsönhatásba lépni az ilyen hullámhosszúságú elektromágneses sugárzással. Ugyanakkor jelentős abszorpció figyelhető meg extrém ultraibolya hullámhosszokon,[27] mintegy 100 nanométertől kezdődően. Ez szorosan összefügg a molekula olyan állapotai közötti elektron-átmenetekkel, melyek során az elektronok nem egyenlő mértékben oszlanak meg az atomok között. A nitrogén abszorpciója vezet a Föld, illetve más bolygók felső légkörében az ultraibolya sugárzás jelentős elnyeléséhez. Ez a jelenség megvédi a földi életet a halálos sugárzásoktól, azonban zavaró körülmény a csillagászati képalkotások során.[28] Hasonló okokból a tiszta molekuláris nitrogén lézerek jellemzően az ultraibolya tartományban bocsátanak ki fényt. A nitrogén hozzájárul a sarki fény kialakulásához, annak révén, hogy nagy energiájú elektromágneses sugárzás hatására a nitrogén elektronjai magasabb héjakra ugranak (az atom gerjesztett állapotba kerül), majd innen fénykibocsátás mellett alapállapotba kerül vissza (az elektronok alacsonyabb héjakra ugranak).[29] A Föld felső légkörének kék ragyogását (földfény), és a légkörbe belépő űrhajók ablakában látszódó kékes izzást jellemzően nem a molekuláris nitrogén, hanem az oxigénnel egyesülő szabad nitrogénatomok okozzák, mely folyamatban nitrogén-monoxidot (NO) képeznek.[forrás?] A nitrogéngáz is mutat szcintillációt. Reakciói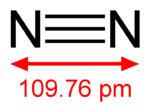 A nitrogén standard hőmérsékleten és nyomáson általában véve nem reakcióképes elem. A nitrogéngáz csak kevés vegyülettel reagál spontán, ellenáll a savaknak és bázisoknak, valamint az oxidálószereknek és a legtöbb redukálószernek. Kivételt képez a lítium, amellyel a nitrogén szobahőmérsékleten is reagál, így lítium-nitrid (Li3N) képződik:[30] Magasabb hőmérsékleten a magnézium is reakcióba lép a nitrogénnel, magnézium-nitridet képezve.[31] Égése a természetben villámláskor játszódik le; a nitrogén magas, körülbelül 3000 °C hőmérsékleten egyesül az oxigénnel (lent). A nitrogén-monoxid azonban keletkezhet tüzelési folyamatokban;[32] illetve enzimatikus segítséggel szintetizálódhat az emlősök és a primitív élőlények sejtjeiben is.[33]  A N2 számos adduktumot képez az átmenetifémekkel. Az első példa dinitrogén-komplexre a [Ru(NH3)5(N2)]2+. Azonban érdekes megjegyezni, hogy az N2 ligandum hidrazin bomlásából származik, és nem szabad dinitrogén hozzákapcsolódásából. Ma már számos ilyen vegyület létezik, beleértve például: IrCl(N2)(PPh3)2; W(N2)2(Ph2PCH2CH2PPh2)2; és [(η5-C5Me4H)2Zr]2(μ2, η2,η2-N2). Ezek a komplexek szemléltetik, hogy a dinitrogén hogyan kötődhet fémekhez a nitrogenáz enzimekben; illetve a Haber–Bosch-eljárás katalizátorában.[34] 2005-ben publikáltak egy katalitikus eljárást, amely molibdén-komplex és proton forrás jelenlétében ammóniává redukálja a nitrogént.[30] A nitrogénvegyületek ipari célú előállításának kiinduló lépése a Haber-eljárás; amelyben a nitrogént N2 és H2 reakciójával kötik meg, vas(II, III)-oxid (Fe3O4) katalizátor jelenlétében körülbelül 500 °C-on, 200 atmoszféra nyomáson. A biológiai nitrogén megkötés a természetben élő cianobaktériumokban és a növények gyökerében szintén molekuláris nitrogénből állít elő ammóniát. A bioszférában lévő nitrogén zömének forrását jelentő reakciót vas- és molibdénatomokat tartalmazó nitrogenáz enzim komplex katalizálja; energiája (−20,5 kJ/mol) pedig az adenozin-trifoszfát (ATP), adenozin-difoszfátot és szervetlen foszfátot eredményező hidrolíziséből származik.[forrás?]
ElőfordulásaA nitrogén a Föld légkörének leggyakoribb összetevője (a száraz levegő 78,082 térfogat-, illetve 75,3 tömegszázaléka nitrogén).[35] Ez a nagy koncentráció azonban nem tükrözi a nitrogén alacsony előfordulását a Föld összetételében, mert az elem nagy részét a Nap még a bolygó kialakulásának korai szakaszában elpárolgatta. A nitrogén gyakori elem az univerzumban, tömeg szerint közelítőleg a hetedik leggyakoribb kémiai elem a galaxisunkban és a Naprendszerben. Az ottani előfordulásáról azt gondolják, hogy teljes egészében a szupernóvákban fuzionálódó hidrogén és szén eredményeképpen jön létre.[36] A Far Ultraviolet Spectroscopic Explorer segítségével csillagászok molekuláris nitrogént és nitrogénvegyületeket mutattak ki a csillagközi térben.[37] Az elemi nitrogén, illetve a hidrogénnel és oxigénnel alkotott gyakori vegyületei illékonyságuk miatt, a Nap hője következtében gáz formában eltűntek a korai Naprendszer planetezimáljairól; így elvesztek a belső Naprendszer kőzetbolygói számára. A nitrogén ennélfogva viszonylag ritka elem e belső bolygókon, köztük a Föld egészén. Ebben a tekintetben a neonra emlékeztet, amely hasonló előfordulással bír a világegyetemben; ezzel szemben ritka elem a belső Naprendszerben. A nitrogén becslések szerint a földkéreg 30. leggyakoribb összetevője. Létezik néhány viszonylag ritka nitrogénásvány, mint például a salétrom (kálium-nitrát), a chilei salétrom (nátrium-nitrát) és az ammónium-klorid. Ezek is elsősorban kiszáradt óceáni ágyakból mint koncentrátumok ismertek, mivel a természetben előforduló nitrogénvegyületek közül jobban oldódnak vízben.[forrás?] Hasonló történik a szintén meglehetősen ritka elem, a bór oldhatósága kapcsán is. A nitrogén és vegyületei azonban sokkal gyakoribbak gáz formában azon bolygók és holdak légkörében, melyek elég nagyok ahhoz, hogy atmoszférájuk legyen.[38] Például, a molekuláris nitrogén nem csupán a Föld légkörének; hanem a szaturnuszi hold, a Titán sűrű légkörének is fő alkotórésze. Továbbá, köszönhetően a gravitáció visszatartó erejének alacsonyabb hőmérsékleten, a nitrogén és vegyületei értékelhető mennyiségben fordulnak elő a gázóriások légkörében.[39] A nitrogén jelen van minden élő szervezetben, a fehérjékben, a nukleinsavakban, és más molekulákban. Jellemzően a növényi anyagok száraz tömegének körülbelül 4%-át, és az emberi test körülbelül 3%-át teszi ki. Jelentős összetevője az állati hulladéknak (például guanó), általában karbamid, húgysav, ammóniumvegyületek, és ezen nitrogéntartalmú termékek származékainak formájában található meg; melyek alapvető tápanyagai az összes olyan növénynek, melyek nem tudják megkötni a légköri nitrogént.[forrás?] FelhasználásaNitrogéngáz A nitrogéngázt számos területen alkalmazzák (például inert gázként helyettesíti a levegőt ott, ahol az oxidáció nemkívánatos[40]):
A nitrogént a kémiai analízisben is elterjedten alkalmazzák a minták előkészítésekor. Arra használják, hogy töményítsék és csökkentsék a folyadékminták térfogatát. A nyomás alatt lévő nitrogéngázt merőlegesen a folyadék felszínére irányítva, lehetővé válik, hogy az oldószer elpárologjon, miközben az oldott anyag(ok) hátramaradnak.[45] Cseppfolyós nitrogén A cseppfolyós nitrogén egy kriogén folyadék. Légköri nyomáson −195,8 °C-on forr. Ha megfelelő tartályban, például termoszban szigetelik el, jelentős párolgási veszteség nélkül szállítható.[46] A szárazjéghez hasonlóan a folyékony nitrogént főleg hűtőközegként használják fel. Többek között vér, reproduktív sejtek (sperma és petesejt), illetve egyéb biológiai minták és anyagok krioprezervációjára használható fel.[47] A krioterápia során klinikailag a bőrön alkalmazzák, hogy eltávolítsák a cisztákat és szemölcsöket.[48] Bizonyos laboratóriumi berendezésekben a hidegcsapdákban alkalmazzák, illetve felhasználják röntgendetektorok vagy infravörös érzékelők hűtésére. Alkalmazzák órajelnél gyorsabban működtetett számítógépek központi feldolgozóegységeinek és egyéb eszközeinek hűtésére, melyek a normál működésnél több hőt termelnek.[49] NitrogénvegyületekA nitrogén összekapcsolása, illetve megkötése a modern ipari kémia legfontosabb jellemzője. A nitrogénből és a földgázból a Haber–Bosch-eljárással ammónia állítható elő. Az ammónia egyrészt közvetlenül felhasználható (elsősorban műtrágyaként és nitro-műtrágyák előállítására);[15] másrészt más fontos anyagok – beleértve a robbanóanyagokat is – prekurzoraként, az Ostwald-eljárással előállított salétromsav útján.[40] A salétromsav szerves és szervetlen sói a kémiai energia történelmileg fontos és kényelmes tárolói voltak. Ezek közé fontos vegyületek tartoznak, például a kálium-nitrát (amit a lőporban használtak)[50] és az ammónium-nitrát, amely fontos műtrágya[35] és robbanóanyag (lásd ANFO). Egyéb különböző nitrált szerves vegyületek, mint a nitroglicerin, a trinitrotoluol,[50] és a nitro-cellulóz[51] robbanóanyagokként és a modern lőfegyverek hajtóanyagaiként használatosak. A salétromsavat oxidálószerként használják a folyékony üzemanyagú rakétákban. A hidrazin és származékai rakéta-üzemanyagokként és hajtógázokként használhatóak fel. A legtöbb ilyen vegyület instabilitását és robbanásra, illetve égésre való hajlamát az okozza, hogy a nitrogén oxidként, és nem a sokkal stabilabb nitrogén molekulaként (N2) van jelen, amely ezen vegyületek termikus bomlásának eredménye. Amikor a nitrátok elégnek vagy felrobbannak, a kialakuló dinitrogénmolekula erős hármas kötése termeli a legtöbb energiát a reakció során. A nitrogén összetevője minden nagyobb gyógyszerosztály molekuláinak a farmakológiában és az orvostudományban. A dinitrogén-oxidot (N2O) a 19. század elején fedezték fel, mint részleges érzéstelenítő, habár azt csak később használták műtéti érzéstelenítésre. Kéjgáznak nevezték, és úgy találták, hogy belégzése a részegséghez hasonlító állapotot idéz elő. Egyéb említésre méltó nitrogéntartalmú gyógyszerek a növényi alkaloidokból származó drogok, mint például a morfin (sok alkaloida létezik, amelyről ismert, hogy farmakológiai hatású; egyes esetekben ezek a növény ragadozókkal szembeni természetes kémiai védelmét szolgálják). A nitroglicerin és a nitroprusszid ismert vérnyomás- és a szívműködés-szabályzók, melyek a nitrogén-monoxid hatását utánozzák. VegyületeiA nitrogén legfontosabb semleges hidridje az ammónia (NH3), noha a hidrazint (N2H4) is gyakran alkalmazzák. Az ammónia 6 nagyságrenddel bázikusabb, mint a víz. Oldatban ammóniumiont (NH4+) képez. A folyékony ammónia (forráspontja 240 K) amfoter anyag (azaz kijelzi a Brønsted-Lowry féle savas vagy bázikus jelleget is), ezenfelül amidionokat képez (NH2–). Amid és nitrid (N3−) sók is ismertek, de ezek vízben lebomlanak. Az ammónia alkil-vegyületekkel egy-, két-, három- illetve négyszeresen szubsztituált vegyületei az aminok. A négyszeresen szubsztituált, úgynevezett kvaterner aminok kereskedelmileg és biológiailag is egyaránt jelentősek; mindemellett mivel a négy szubsztituens egy pozitív töltésű nitrogénatomot eredményez, így ezek egyben vízben oldható, vagy legalábbis amfoter vegyületek.[forrás?] A nitrogén anionok (negatív töltésű ionok) másik nagy csoportja a mérgező azidok (N3–). Az azidok lineáris molekulák, és bár elektronszerkezetük a szén-dioxidhoz hasonló, de a szervezetben a cianidokhoz hasonló módon kötődnek a vas-tartalmú enzimekhez. Egy másik, azonos szerkezetű molekula a színtelen és viszonylag inert altatógáz, a dinitrogén-oxid (dinitrogén-monoxid, N2O), más néven kéjgáz. Ez a vegyület a különböző nitrogén-oxidok egyike, mely családot gyakran NOx-ként rövidítik. A nitrogén-monoxid (NO) egy természetes szabad gyök, amelyet növények és állatok egyaránt használnak a jelátvitel során; például értágulatkor (vazodilatáció) a vérerek simaizom-szöveteinek elernyedését okozza. A vöröses színű, és mérgező nitrogén-dioxid (NO2) párosítatlan elektront tartalmaz; illetve fontos összetevője a szmognak. A párosítatlan elektront tartalmazó nitrogén vegyületek hajlamosak a dimerizációra (így párosíva az elektronjaikat), és általában véve nagyon reaktívak. A kapcsolódó savak a salétromossav HNO2, és a salétromsav HNO3; sóik a nitritek és a nitrátok. A többi oxid, mint például a dinitrogén-trioxid (N2O3), a dinitrogén-tetroxid (N2O4), illetve a dinitrogén-pentoxid (N2O5), nem stabil, és robbanásveszélyes; amely egyenes következménye az N2 kémiai stabilitásának. Szinte mindegyik hipergol-hajtóanyagú rakéta N2O4 használ oxidálószerként; ezek üzemanyagai a hidrazin különböző származékai, melyek szintén nitrogénvegyületek. Ezeket a rakéta-hajtóműveket széles körben használták, a Space Shuttle-n és az Apollo-program rakétáin, mert e hajtóanyagok szobahőmérsékleten folyadékok, és külön gyújtó-rendszer nélkül, érintkezéskor begyulladnak; ez lehetővé teszi a pontosan szabályzott égést. Néhány rakéta, mint a Titan II és az Ariane 1-4 is hipergol üzemanyagokat használ, bár a trend távolodik ezektől költségvetési és a biztonsági okok miatt. Az N2O4 a salétromsav (HNO3) előállításának köztes terméke, és egy meglehetősen erős oxidálószer. A nitrogén figyelemre méltó azokról a robbanásszerűen instabil vegyületekről, amelyek belőle állíthatóak elő. A nitrogén-trijodid (NI3) egy rendkívül érzékeny robbanóanyag. A nitrocellulóz, amelyet cellulóz salétromsavval történő nitrálásával állítanak elő, lőgyapot néven is ismert. A glicerin nitrálásával gyártható nitroglicerin a dinamit veszélyesen instabil robbanásveszélyes összetevője. A hozzá képest stabilabb, de kevésbé erős robbanóanyag, a trinitrotoluol (TNT) az a standard robbanóanyag, amelyhez a nukleáris robbantások erejét mérik.[52] A nitrogén szerves vegyületekben is megtalálható. A gyakori nitrogéntartalmú funkciós csoportok közé tartoznak: az aminok, az amidok, a nitro-csoportok, az iminek, és az enaminok. Egy vegyi anyag nitrogén tartalmát a Kjeldahl-módszerrel lehet meghatározni. Biológiai szerepeA nitrogén nélkülözhetetlen építőköve az amino- és nukleinsavaknak, amelyek alapvető fontosságúak a földi élet számára.[35] A légkörben lévő elemi nitrogént közvetlenül nem tudják felhasználni sem a növények, sem az állatok; át kell alakítani (meg kell kötni) megfelelő állapotba, hogy hasznos legyen a magasabb rendű növények és állatok számára. A csapadék gyakran tartalmaz jelentős mennyiségű ammóniumiont és nitrátot, melyről azt gondolják, hogy a villámlás, illetve egyéb légköri elektromos jelenségek nitrogén megkötésének eredménye.[53] Ezt először Liebig javasolta 1827-ben, majd később megerősítették.[53] Mivel azonban az erdő lombkoronája a légköri nitráthoz képest jobban megtartja az ammóniumionokat, a kötött nitrogén többsége nitrátként éri el a talaj felszínét a fák alatt. A fa gyökerei ezzel szemben előnyösebben asszimilálják a talaj-nitrátokat, mint a talajbeli ammóniumionokat.[54] Egyes különleges baktériumok (pl. Rhizobium trifolii) rendelkeznek nitrogenáz-enzimmel, amely ammóniumion formájában megköti a légköri nitrogént, így kémiailag hasznossá alakítja a magasabb rendű szervezetek számára. Ehhez a folyamathoz nagy mennyiségű energia és anoxiás körülmények szükségesek. Ezek a baktériumok képesek szabadon élni a talajban (pl. Azotobacter), de általában egy szimbiotikus kapcsolatban élnek a hüvelyes növények (pl. lóhere (Trifolium), vagy szójabab (Glycine max)) gyökérgumóival. A nitrogén-megkötő baktériumok szintén szimbiózisban élnek számos független növényfajjal is, például az égerrel (Alnus), a zuzmókkal, a kazuárfával (Casuarina), a májmohákkal, és az óriáslapuval (Gunnera).[55] A szimbiotikus kapcsolat részeként a növény a megkötött ammóniumionokat nitrogén-oxidokká és aminosavakká alakítja, hogy fehérjéket és más molekulákat (például alkaloidokat) képezzen belőlük. Mindezért cserébe a növény cukrot juttat (szekretál) a szimbióta baktériumoknak.[55] A hüvelyesek anaerob (oxigénmentes) környezetet tartanak fenn a nitrogén-megkötő baktériumok számára.[forrás?] A növények képesek asszimilálni a nitrogén közvetlenül nitrátok formájában is, melyek jelen lehetnek a talajban természetes ásványok, műtrágyák, állati hulladék, vagy szerves bomlás (nem kifejezetten a növényhez kapcsolódó baktériumok termékeként) formájában. Az ilyen módon elnyelt nitrátok először nitritekké alakulnak a nitrát reduktáz enzim hatására, majd a nitrit reduktáz enzim ammóniává alakítja őket.[55] A nitrogén vegyületek az állati biológia alap építőkövei is egyben. Az állatok növényi eredetű nitrogéntartalmú aminosavakat használnak kiindulási anyagként a nitrogén-biokémiájukhoz, beleértve a fehérjék és nukleinsavak gyártását is. A növényeken táplálkozó rovarok függenek az étrendjükben szereplő nitrogéntől, oly módon, hogy a növényre szórt nitrogén-műtrágya mennyiségének változtatása kihatással van a növényből táplálkozó rovarok szaporodási ütemére.[56] Az oldható nitrátok fontos korlátozó tényezői bizonyos, az óceán vizein élő baktériumok szaporodásának.[57] Sok helyen a világon, a termőföldeken alkalmazott műtrágyázás eredményeképpen az elfolyó oldható nitrogén a folyótorkolatoknál az óceánokba jut. Ez a folyamat a vizek eutrofizációját eredményezheti, mivel a nitrogénalapú baktériumok elszaporodása kimeríti víz oxigéntartalmát, míg végül a magasabbrendű organizmusok elpusztulnak. A szennyező folyamatok miatt jól ismert „holt zóna” a Mexikói-öböl partvidéke, és a Fekete-tenger.[forrás?] Sok tengeri hal nagy mennyiségű trimetilamin-oxidot állít elő, hogy megvédje őket a környezetük erős ozmotikus hatásai ellen; ennek a vegyületnek a dimetilaminná alakulása felelős a nem-friss tengeri halak korai szagáért.[58] Az állatokban, az aminosavakból származó nitrogén-monoxid (NO) szabad gyökök, fontos szabályozó molekulák a keringésben.[57] A nitrogén-monoxid vízzel való gyors reakciója az állatokban nitrit anyagcseretermékek termelődését eredményezi. Az állatok nitrogén anyagcseréje a fehérjékben általában karbamid kiválasztását; míg a nukleinsavakban karbamid és húgysav kiválasztását eredményezi. A bomló állati hús jellegzetes szagát hosszú szénláncú, nitrogén-tartalmú aminok keletkezése okozza; mint például a putreszcin és kadaverin, melyek az ornitin és lizin - aminosavak - illetve a pusztuló fehérjék bomlástermékei.[59] Az organizmusok hulladékai és bomlástermékei előállítanak ugyan kis mennyiségű nitrátot, de a nitrogéntartalom nagy része végül molekuláris nitrogén formájában visszatér a légkörbe. A nitrogén körforgása a légkörből az organizmusokba, majd onnan vissza: a nitrogén ciklus.[55] BiztonságNitrogéngáz gyors felszabadulása zárt térben kiszoríthatja az oxigént, következésképpen a fulladás veszélye áll fenn. Elképzelhető néhány figyelmeztető tünet, mivel az emberi karotid test (glomus caroticum) egy viszonylag lassú és rossz oxigénhiány (hypoxia) érzékelő rendszer.[60] Hasonló eset történt röviddel az első Space Shuttle űrsikló-misszió fellövése előtt 1981-ben, amikor két technikus elvesztette az eszméletét (és egyikük meghalt), mert beléptek az űrsikló mobil indítóállványának egy kamrájába, amely tűzvédelmi elővigyázatosságból tiszta nitrogénnel volt nyomás alá helyezve.[forrás?] Amikor az ember magas parciális nyomású nitrogént lélegez be (magasabb, mint kb. 4 bar; búvárkodás esetén 30 méter alatti mélységben tapasztalható) a gáz érzéstelenítő szerként kezd hatni. Ez nitrogén narkózishoz vezethet, amely egy átmeneti, félig altatott agykárosító állapot, hasonló ahhoz, amit a dinitrogén-oxid okoz.[61][62] A nitrogén emellett feloldódik a véráramban és a test zsírszöveteiben. A gyors dekompresszió (túl gyorsan felemelkedő búvárok, vagy kabin nyomásról szkafander nyomásra túl hamar áttérő űrhajósok esetén) egy potenciálisan végzetes állapothoz vezethet, amelyet keszonbetegségnek (másik nevén dekompressziós betegség) neveznek; mely során nitrogén buborékok keletkeznek a véráramban, az idegekben, ízületekben, és egyéb érzékeny vagy fontos területeken.[63][64] Egyéb inert gázok (a szén-dioxidon és az oxigénen kívül) használata azonos hatású buborékokat eredményez, így a nitrogén, mint gázkeverék lecserélése megakadályozza ugyan a nitrogén narkózis kialakulását, de nem akadályozza meg a dekompressziós betegséget.[65] A folyékony nitrogénnel való közvetlen érintkezés súlyos fagyási sérüléseket okoz. Ez a folyékony nitrogén formájától függően vagy azonnal az érintkezéskor, vagy néhány másodperccel azt követően következik be. Az ömlesztett folyékony nitrogén kevésbé gyors fagyást okoz, mint egy permetnyi nitrogén-köd (melyet a dermatológiai gyakorlatban bizonyos bőrelváltozások lefagyasztására használnak). A nitrogénnel átitatódott anyagok általi extra felület is fontos szereppel bír; az átitatódott ruházat vagy pamut sokkal gyorsabb fagyást eredményez, mintha a folyadék közvetlenül a bőrre kerülne. A csupasz bőr, és a folyékony nitrogén cseppek közti „teljes” érintkezést ugyanis a Leidenfrost-hatás következtében létrejött szigetelő gázréteg megakadályozza. Ez a jelenség néhány másodpercnyi védelmet biztosít a fagyás ellen. Azonban a bőrön, vagy a szöveteken alkalmazott nitrogén-permet megkerüli ezt a hatást, és emiatt helyileg azonnali fagyási sérülést okoz. Bizonyos esetekben biztonsági okokból oxigénérzékelőket alkalmaznak, ha zárt térben kell folyékony nitrogénnel dolgozni, így időben figyelmeztetni lehet a munkásokat a gázszivárgásra.[66] Jegyzetek
Fordítás
További információk
Kapcsolódó szócikkek |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||












