| 緑膿菌
|
![]()
|
| 分類
|
|
|
| 学名
|
Pseudomonas aeruginosa
(Schroeter 1872) Migula 1900
|
緑膿菌(りょくのうきん、学名、Pseudomonas aeruginosa)は、細菌に分類される、グラム陰性で好気性の桿菌の1種であり、地球上の環境中に広く分布している代表的な常在菌の1つでもある。ヒトに対しても病原性を持つが、健常者に感染しても発病させることは無い。ただし免疫力の低下した者に感染すると、日和見感染症のうちの1つである緑膿菌感染症を起こす。
元々、緑膿菌は消毒薬や抗菌薬に対する抵抗性が高い上に、ヒトが抗菌薬を使用したことにより薬剤に対する耐性を獲得したものも多いため、緑膿菌感染症を発症すると治療が困難である。このため緑膿菌は、日和見感染症や院内感染の原因菌として医学上重要視されている。
名称の由来
「緑膿菌」という和名は、本菌が傷口に感染(創傷感染)したときに、しばしば緑色の膿が見られることから名付けられた。学名であるPseudomonas aeruginosaの種形容語のaeruginosaも「緑青に満ちた」を意味するギリシア語に由来し、本菌が作る緑色色素(ピオシアニン。後述)に因んだ名称である。なお、属名のPseudomonasは、それぞれギリシア語のpseudo-(偽の)とmonas(鞭毛を持った単細胞原生生物の総称)に由来する。
細菌学的特徴
シュードモナス属に属する、0.7 x 2 µm程度の大きさのグラム陰性桿菌である。芽胞は形成せず、菌体の一端に1本の鞭毛(まれに2-3本)を持ち活発に運動する。また菌体の一端には線毛を有する。
緑膿菌は、土壌、淡水、海水中など、自然環境のいたるところに生息する環境中の常在微生物の一種であり、湿潤な環境を特に好む。またヒトや動物の消化管内部にも少数ながら存在する腸内細菌の一種であり、健康な成人の約15%、病院内では30-60%が本菌を保有していると言われる。
偏性好気性であり、通常は酸素のない環境では生存できない。これはもっぱら呼吸によってのみエネルギー産生し、発酵を行わないためである。他の病原細菌と比べて、発育には特殊な栄養を必要としない(栄養要求性が低い)ため、増殖しやすい細菌である。微量の有機物でも増殖が可能であり、長期保存している蒸留水の容器にすら、混入したわずかな有機物を栄養源として緑膿菌が増殖することがある。人工的に培養する場合にも、アンモニウム塩を含む無機塩培地に、炭素源となる一種類の有機物があれば培養が可能である。至適発育温度は37℃前後で、42℃程度の高温でも増殖可能であるが、低温(4℃以下)では増殖しない。有機物を分解して、アミンの一種であるトリメチルアミンを産生するため、独特の臭気(腐った魚のような臭い)を生じる。
緑膿菌は、熱に対する抵抗性は他の細菌と同程度で比較的弱い部類に属する(55℃1時間処理で死滅)が、消毒薬や抗生物質などに対しては、広範かつ強い抵抗性を有している(薬剤抵抗性の節に詳述)。このため、長期間放置されている手洗い用の消毒液などの中からも分離されることがあり、院内感染などとの関連から特に医療分野で注目されている。
緑膿菌の物質産生
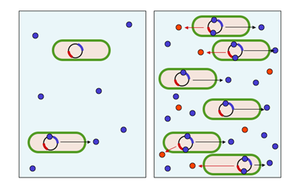 クオラムセンシング
クオラムセンシング
左図:細菌密度が低い状態では、オートインデューサー(青)の濃度も低く、物質の産生があまり起こらない。
右図:細菌密度が高くなると、オートインデューサーの濃度が上がって、クオラムセンシング特有の物質(赤)が産生される。
緑膿菌は、色素やムコイド、外毒素など、本菌特有の多種類の物質を産生する。これらの物質は緑膿菌の菌体外に分泌され、その生育環境に影響を与えることで緑膿菌の生育を助ける役割を果たすだけでなく、宿主細胞に作用することでその病原性とも密接に関連している。
これら緑膿菌の物質産生の多くは、その生育環境での菌数を感知する、クオラムセンシングと呼ばれる機構で制御されている。緑膿菌は、N-アシル-L-ホモセリンラクトン (AHL) と呼ばれる、菌体の内外を自由に行き来することが可能な低分子物質(オートインデューサー)を産生しており、環境中での生育密度が上がると、この物質の濃度も上昇する。この物質は、緑膿菌のさまざまな遺伝子に対して転写因子として働き、さまざまな物質産生を誘導する。AHL自身もまたAHLによってその産生が誘導されるため、この機構は正のフィードバックによる制御を受けている。これらの機構を巨視的に見ると、緑膿菌が自らの生育密度を感知して、その上昇に伴って、さまざまな物質産生を行うことになる。クオラムセンシングは、緑膿菌同士が細胞間で行う1種の情報伝達機構と考えることができる。
色素産生
- 緑膿菌は複数の色素を産生する性質を持つ。非蛍光緑色色素であるピオシアニン、蛍光性の黄緑色のピオベルジン(フルオレシン)とフルオレセイン[1]、赤色のピオルビン、黒褐色のピオメラニンなど、少なくとも5種類の色素を産生する(中には一部の色素を産生しない変異株も存在する)。このうち、ピオシアニンとピオベルジンの二つは特に研究が進んでいる。
 緑膿菌によるピオシアニン(非蛍光緑色色素)の産生。
緑膿菌によるピオシアニン(非蛍光緑色色素)の産生。
左は緑膿菌を培養した培地。偏性好気性菌であるため培地の表面近くだけに増殖して(バイオフィルムの形成、白い部分)、そこから培地下方に向けて産生したピオシアニンが拡散している。右は緑膿菌培養前の培地。
 緑膿菌によるピオベルジン(黄緑色の蛍光色素)の産生。
緑膿菌によるピオベルジン(黄緑色の蛍光色素)の産生。
紫外線下で観察すると培地の表面に増殖した緑膿菌から培地下方に向けて、産生されたピオベルジン(紫外線下のため青白く見える)が拡散しているのがわかる。
- ピオシアニンはクロロホルムに可溶性の緑色色素である。ピオシアニンを産生するのは緑膿菌しかいないため、この性質を利用した「ピオシアニン検出用シュードモナス寒天培地」という寒天培地も販売されており[2]、緑膿菌の鑑別同定や研究等に用いられている[3]。 菌体外に分泌され、緑膿菌を培養した培地や、感染した傷口などを緑色に着色する。緑膿菌の発見のきっかけになった包帯の緑変や、学名および和名は、このピオシアニンによる緑色に由来する。またピオシアニンという名称自体、膿を意味する接頭語 pyo-と、シアン(藍緑色)を表すcyanに由来しており、1900年前後に緑膿菌の学名として付けられたシノニム(同種異名)であるBacillus pyocyaneousなどの種小名にちなんでいる。ピオシアニンは、哺乳動物細胞のミトコンドリアによる呼吸機能や気道粘膜の繊毛運動を阻害する毒性を持っており、緑膿菌の病原性の一端を担っている。
- ピオベルジンは、フルオレシン(fluorescin)とも呼ばれる。またピオベルジンは加熱によって可視光下の色が赤〜橙色に変化する性質を持ち、古くなった米飯を加熱すると黄色くなる場合(「赤めし」と呼ばれる現象)、米飯に混入した緑膿菌が産生したピオベルジンの加熱変色が、その原因の一つだと言われる。ピオベルジンは分子内にジヒドロキシキノリン構造を持ち、鉄イオンと強く結合する。鉄イオン濃度の低い環境でよく産生される。菌体から周囲に分泌されたピオベルジンは、増殖に必要な鉄イオンを保持し、それを菌体に効率よく供給するという、シデロフォアとしての役割を担っていると考えられている。
ムコイドとバイオフィルム
緑膿菌の一部には、ムコイドと呼ばれる粘質物を産生して、菌体外に分泌するものがある。これらをムコイド型緑膿菌と呼び、これに対してムコイドを作らないものを非ムコイド型緑膿菌と呼ぶ。ムコイドの主成分は、アルギン酸とよばれる粘性の高いムコ多糖である。ムコイド型緑膿菌が増殖した場所では、分泌されたムコイドが菌体を覆い包んで、薄層(フィルム)を形成する。このような微生物が形成する薄層状のものをバイオフィルムと呼び、緑膿菌はこのバイオフィルムを生活の場として、その内部で効率よく増殖、生存している。
バイオフィルムは物質表面に対して強く付着しているため、その中で生存している菌は、むきだしの状態に比べると、洗い流したり剥がしたりするなどの機械的な除去に対して強くなる。またバイオフィルムの内部には消毒薬などの薬剤が浸透しにくいため、化学的な刺激に対しても抵抗性が増す。また他の微生物による捕食や白血球などによる貪食などの、生物的な排除からも逃れやすくなる。さらに緑膿菌から分泌されるAHLなどの物質も拡散しにくく、その局所的な濃度が上がりやすくなるため、クオラムセンシングなどの分泌制御機構も働きやすくなる。これらによって、バイオフィルムは緑膿菌の生育を助ける重要な役割を担っている。
一方、医学的な観点からは、ムコイドやバイオフィルムの産生が病原性や感染リスクの増加につながるため、問題視されることが多い。感染患者から分離される病原性緑膿菌のほとんどはムコイド型であり、感染した粘膜表面などでバイオフィルムを形成する。このことによって、白血球による貪食や抗体、補体など、宿主の免疫機構による排除から逃れやすくなり、さらに抗生物質の浸透性低下によって治療も困難になる。また、医療用カテーテルの内側などで緑膿菌がバイオフィルムを形成して増殖することで院内感染を起こすケースなども報告されており、感染リスクの増加も問題視されている。
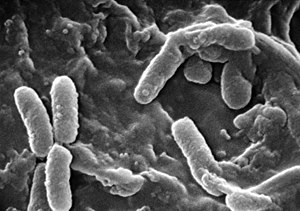 緑膿菌(ムコイド型)の走査型電子顕微鏡写真。
緑膿菌(ムコイド型)の走査型電子顕微鏡写真。
菌体の表面に分泌されたムコイドが付着し、さらに一部の菌(右部)はそれに埋もれて菌全体の形が判別しにくくなっている。
嚢胞性線維症患者体内でのバイオフィルム形成
緑膿菌によるバイオフィルムの形成は、遺伝性疾患である嚢胞性線維症(CF)患者に対する緑膿菌感染の原因となる。このバイオフィルムは気道内の粘液に形成され、緑膿菌の生息場所となる。それに加え、CF病患者のバイオフィルムに生息する緑膿菌は(歴史的に、全てのシュードモナス属菌は偏性好気性生物に分類されていたにもかかわらず)嫌気呼吸を行うようになる[4]。
呼吸形態を嫌気的に変更することは、緑膿菌の増殖を促進する。嫌気呼吸は、バイオフィルムの主要成分であるアルギン酸を多量に生産する表現型の維持に有利である。このため、CF病患者の年齢が増加するにつれ、バイオフィルムの増大により気道内の粘膜が肥大化する。粘膜の肥大化は、粘膜内の菌叢において嫌気性菌を優勢にし、緑膿菌の持続的な繁殖を促す。
この嫌気呼吸において、好気呼吸時に用いられない外膜タンパク質のOprFおよび細胞内rhl量感知回路が要求される。OprFがないとき、rhlRまたはrhllの欠乏中に亜硝酸還元活性が失われ、このことが一酸化窒素の過剰産生による自滅を誘発し、緑膿菌の生育は極端に弱くなる[4]。
CF病の治療に用いられている抗生物質の多くは、緑膿菌の呼吸形態の変更により効果が減少するか全くなくなるため、嫌気的な代謝を攻撃する新しい抗生物質の開発が望まれている。
菌体外毒素と分泌酵素
緑膿菌は、さまざまなタンパク質を菌体外に分泌している。これには外毒素や溶血素、分泌酵素として働くものが含まれており、緑膿菌の病原性と密接に関連している。
緑膿菌が分泌する外毒素の代表は、エキソトキシンA(外毒素A)である。臨床から分離される緑膿菌の90%がエキソトキシンA産生性である。エキソトキシンAは、ジフテリア菌が作るジフテリア毒素と同じ生理活性を持つ毒素である。すなわち、エキソトキシンAがペプチド伸長因子であるEF2をADP-リボシル化することで、動物細胞のすべてのタンパク質合成を不可逆的に阻害し、最終的に細胞は死に至る。この他、EF2以外の何らかの分子を標的にADP-リボシル化する活性を持つエキソエンザイムS(細胞外酵素S)も分泌することが知られている。
緑膿菌が分泌する溶血素には、強い細胞傷害性を持つヘモリジン(タンパク質性の溶血毒)と、溶血殺菌作用を持つラムノリピドの二種類が知られている。血液寒天培地上ではβ溶血性を示す。また分泌酵素としては、アルカリペプチダーゼや、エラスターゼ、コラゲナーゼ、リパーゼなどを産生する。これらは感染部位の組織を破壊し、細菌の侵入や増殖を容易にすると同時に、出血や壊死などを引き起こす病原因子として働く。
薬剤抵抗性
一般に、グラム陰性菌の方がグラム陽性菌よりも、薬剤抵抗性が強い傾向にあるが、緑膿菌はグラム陰性菌の中でも特に強い薬剤抵抗性を持つ、すなわちこれらの薬剤による殺菌に強い抵抗力を持つことで知られる。
この抵抗性には、緑膿菌が元から持っていたもの(自然耐性)と、後天的に獲得したもの(獲得耐性、いわゆる薬剤耐性)がある。これらが組み合わさることで、緑膿菌の薬剤抵抗性は広い範囲に及んだ、いわゆる多剤耐性の状態にあるものが多く見られる。
消毒薬では逆性石鹸やクロルヘキシジン(ヒビテン Hibitane)などに対する自然耐性が強く、低濃度の場合にはこれらの消毒液中で緑膿菌が増殖することもある。抗細菌薬(いわゆる抗生物質)においては自然耐性の高さだけでなく、獲得耐性によって無効になったものも多い。ペニシリンやセフェム系などのβ-ラクタム系抗生物質、アミノグリコシド系抗生物質は当初から効果がなく、広域ペニシリン、第三世代セフェム、カルバペネム、抗緑膿菌性アミノグリコシド、ニューキノロンなどの開発によって、ようやく緑膿菌治療に有効なものが得られた。ただし、現在ではカルバペネム系薬・アミノグリコシド系薬・ニューキノロン系薬の3系統全てに耐性を示す多剤耐性緑膿菌も出現している。多剤耐性緑膿菌に対して有効と考えられているのは、抗MRSA薬である硫酸アルベカシン、モノバクタム系薬であるアズトレオナム、ポリペプチド系薬である硫酸ポリミキシンBやコリスチンメタンスルホン酸ナトリウムなどである。
この他、緑膿菌は一般に用いる石鹸や食塩による殺菌や静菌効果も低い。一方、酸や銀イオンによる殺菌には感受性であり、またEDTAに対しては感受性を示すだけでなく、EDTA存在下では他の消毒薬の効果が増強される。
緑膿菌の薬物抵抗性には、複数の薬剤耐性メカニズムが関わっている。
- 薬物の細胞内への取り込みを制限する機構。
- 取り込まれた薬物を再び細胞外に排出する機構。
- 獲得した耐性酵素による薬物の分解や修飾。
- 抗生物質の標的となるタンパク質の変化による阻害回避。
- バイオフィルムによる薬剤浸透性の低下。
これらの薬剤耐性は、抗生物質使用によって緑膿菌が既に獲得していた機構が誘導されるだけでなく、性線毛を介した接合による薬剤耐性プラスミド(Rプラスミド)の伝達や、形質導入による薬剤耐性遺伝子の獲得などによって、異なる菌株から新規に伝達される場合もある。
なお、細菌検査の分野では、逆性石鹸の1種である消毒薬のセトリミド(Cetrimide)に抵抗性があることを利用して、セトリミドを加えた培地を用いて選択的に分離培養することができる。セトリミドとともに、抗菌剤であるナリジクス酸を加えた、NAC (Nalidic-Acid, Cetrimide) 培地が緑膿菌の選択分離に用いられている。
病原性
緑膿菌は、健常なヒトに感染しても症状が出ることがほとんどない毒性の低い細菌であるが、免疫力が低下したヒトに、ムコイド型緑膿菌が日和見感染すると、緑膿菌感染症を引き起こす。院内感染によって発生することも多い。発症した場合、緑膿菌の持つ薬剤耐性のために薬剤による治療が困難であることも多い。β-ラクタム系、アミノグリコシド系、ニューキノロン系の3系統の抗細菌薬にそれぞれ有効なものがあるが、これらの系統すべてに対して耐性を獲得した多剤耐性緑膿菌感染症も出現しており、医療上の問題になっている。
緑膿菌感染症
緑膿菌感染症は、健常者には見られないが、免疫抑制剤の使用や後天性免疫不全症候群(エイズ)などにより免疫力の低下した人や、長期間の入院や手術などで体力を消耗している人、寝たきりの状態にある老人など、いわゆる「易感染宿主」に発症する疾患(日和見感染症)である。
医療用カテーテルや気管挿管、外科的手術などの医療行為によって尿道、気道、創傷からの感染を起こしたり、褥瘡や火傷、外傷などで皮膚のバリア機構が失われた部分から感染するケースが多い。このほか、コンタクトレンズ着脱時の損傷によって眼に感染を起こす場合も知られる。局所感染の場合は、眼では角膜炎や炎症、耳(外傷などによる)では「スイマーズイヤー (swimmer's ear、水泳者の耳)」とよばれる外耳炎、皮膚では化膿性発疹などを起こすほか、気道感染による肺炎を起こす場合もある。またこれらの局所感染に引き続き、あるいは創傷などからの血管内への感染によって全身感染を起こし、敗血症、続発性肺炎、心内膜炎、中枢神経感染などの重篤な疾患を引き起こすこともある。特に、緑膿菌敗血症では致死率は約80%に上ると言われている。
緑膿菌と院内感染
医療機関では、(1) 緑膿菌が存在しやすい環境下で、(2) 易感染宿主に対して、(3) 感染原因にもなりうる医療行為を行う、という条件が揃っているため、緑膿菌による院内感染がしばしば問題になる。
緑膿菌は易感染宿主に日和見感染して感染症を引き起こすが、病院などの医療機関は入院、通院を問わず、このような易感染宿主が集まる環境にある。また、医療機関では日常的にさまざまな消毒薬、抗生物質などの薬剤が使用されているため、これらの薬剤に対して感受性のある微生物が増殖しにくい一方で、緑膿菌のように薬剤抵抗性の強い微生物は選択的に生き残りやすい傾向にある。さらに新たな耐性を獲得した薬剤耐性菌も生まれやすい環境である。その上、外科的処置や挿管などの医療行為は、充分な配慮が行われない場合、緑膿菌感染の直接のきっかけになりうる。各医療機関が行っている対策によって、他の病原体とともに緑膿菌の発生状況はモニタリングされ、院内感染の予防が行われているが、環境中の常在菌でもある緑膿菌の完全な除去は困難であり、しばしば院内感染例が報告されている。(患者が保有しているものの他、患者への見舞い品も緑膿菌の感染源となりうる。緑膿菌は花卉商品の用土(土以外が使用されているものも含む)や植物自体に付着・生息している事が多く、そのため病院では院内への緑膿菌の流入を阻止するために見舞い等でも花卉の持ち込みを禁止している所が少なからず存在する。)
治療
緑膿菌感染症の治療は、緑膿菌に対する抗菌性を有する薬剤による化学療法が行われる。第1選択となるアミノグリコシド系のゲンタマイシン、トブラマイシンやアミカシンのほか、ペニシリン系のチカルシリンやピペラシリン、第3世代セフェムであるセフタジジム、また完全合成β-ラクタムであるカルバペネム系のイミペネム・シラスタチン合剤、メロペネム,ドリペネムや、ニューキノロン系のシプロフロキサシンも用いられることがある。
しかし緑膿菌が感染巣でバイオフィルムを形成した場合には、その内部への薬剤の浸透性が低くなるため、完全な除去が困難になるケースも多い。また緑膿菌は比較的、新規の薬剤耐性を獲得しやすいため、上記の治療薬に対する耐性菌、特に多剤耐性緑膿菌の出現が問題になる。
多剤耐性緑膿菌感染症
多剤耐性緑膿菌(MDRP)は1970年代までにはすでにその存在が知られていた。当時は「複数の薬剤耐性を併せ持ったもの」に対する総称であったが、その後、緑膿菌感染症の治療に有効な3系統の薬剤、すなわち、広域β-ラクタム系、アミノグリコシド系、ニューキノロン系に対して、同時に耐性を示すものを指すようになった。特に2000年代以降は、イミペネム(β-ラクタムのカルバペネム系)、アミカシン(アミノグリコシド)、シプロフロキサシン(ニューキノロン系)などに対する耐性を指標とする傾向がある。
多剤耐性緑膿菌感染症は、世界中の医療関係機関によってその発生動向が監視されている。日本では、感染症法で五類感染症定点把握疾患に指定されており、指定医療機関において週単位の発生状況の報告が義務づけられている。コリスチンはMDRP感染症に対して有効な薬剤のひとつである。
歴史
緑膿菌は、1872年にSchroeterによって発見、命名された後、1882年にCarle Gessardによって、緑に着色した包帯から初めて分離、培養された。その後、緑膿菌および緑膿菌感染症についての基礎的な研究が進み、薬剤抵抗性や物質産生のメカニズムが解明されていった。
1929年、アレクサンダー・フレミングによるペニシリンの発見以降、多くの抗生物質が発見、開発された。当初はグラム陽性菌にのみ有効であった抗生物質の中から、グラム陰性菌にも有効なものが徐々に見つかっていったが、緑膿菌に対して効果を示す薬剤はほとんど見つからなかった。1960年代以降になって、ゲンタマイシンなど緑膿菌に有効な抗生物質がいくつか発見された。また新薬開発が続けられていたペニシリン系抗生物質の中から、初めて緑膿菌に対する効果を獲得したカルベニシリンが開発され、これらの薬剤が緑膿菌治療薬として実用化された。しかし、1970年代までには、当時用いられていた複数の抗生物質に対する多剤耐性緑膿菌の存在が知られるようになった。
2000年には、緑膿菌のPAO1株の全ゲノム解読が完了している。
関連項目
ウィキメディア・コモンズには、
緑膿菌に関連するカテゴリがあります。
- 抗菌薬
- ネイルアート - ネイルアートによる緑膿菌の感染被害があり、感染した爪はグリーンネイルと呼ばれる。
脚注
- ^ 助川化学株式会社「緑膿菌」
- ^ アズワン「シュードモナス寒天培地ピオシアニン(ベクトン・ディッキンソン)」
- ^ 金沢医科大学 臨床感染症学・感染症科「質問箱」
- ^ a b Hassett D, Cuppoletti J, Trapnell B, Lymar S, Rowe J, Yoon S, Hilliard G, Parvatiyar K, Kamani M, Wozniak D, Hwang S, McDermott T, Ochsner U (2002). “Anaerobic metabolism and quorum sensing by Pseudomonas aeruginosa biofilms in chronically infected cystic fibrosis airways: rethinking antibiotic treatment strategies and drug targets”. Adv Drug Deliv Rev 54 (11): 1425–1443. doi:10.1016/S0169-409X(02)00152-7. PMID 12458153.
参考文献
外部リンク