|
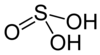
Kwas siarkawy, nazwa Stocka: kwas siarkowy(IV), H
2SO
3 – nieorganiczny związek chemiczny nietrwały kwas tlenowy o słabej/średniej mocy[6][7][8].
Występowanie i właściwości
Jest nieznany w stanie czystym i określany bywa także jako wodny roztwór dwutlenku siarki[1][2][9], jednak w roztworze takim występują liczne indywidua chemiczne, głównie różne hydraty SO
2·nH
2O, a także jony H
3O+
, HSO−
3, S
2O2−
5 i śladowe ilości SO2−
3. W roztworze nie wykryto natomiast cząsteczek H
2SO
3 i przyjmuje się, że jeśli w ogóle one istnieją, to stała równowagi reakcji SO
2·nH
2O ⇌ H
2SO
3 jest znacznie mniejsza od 10−9. Cząsteczki H
2SO
3 wykryto natomiast w fazie gazowej w warunkach jonizacji w spektrometrze masowym[10].
Nasycony roztwór ma stężenie ok. 6%[2] i gęstość 1,03 g/cm³[4].
W temperaturze 0 °C z roztworu wytrącają się hydraty typu klatratów o przybliżonym składzie SO
2·6H
2O[10]. Z metalami tworzy sole – wodorosiarczyny i siarczyny; te drugie są stosunkowo trwałe i wiele z nich otrzymano w formie krystalicznej[10].
Otrzymywanie
Powstawanie kwasu siarkawego:
- SO
2 + H
2O → H
2SO
3
Można go także otrzymać działając roztworem mocnego kwasu na siarczyny. Powstały wówczas kwas siarkawy ulega rozpadowi według równania:
- SO2−
3 + 2H+
→ [H
2SO
3] → SO
2↑ + H
2O
Właściwości
Właściwości kwasu siarkawego:
- nietrwały – rozkłada się podczas ogrzewania,
- bakteriobójczy,
- grzybobójczy,
- ma właściwości bielące,
- niszczy rośliny,
- trujący,
- silnie drażniący,
- jest elektrolitem.
W przeciwieństwie do swoich soli, siarczynów, zastosowanie wolnego kwasu siarkawego jest znikome. W syntezie laboratoryjnej wykorzystuje się go jako środek redukujący. Stosuje się go do bielenia wełny oraz w przemyśle papierniczym.
Kwaśny deszcz to silnie rozcieńczony kwas siarkawy, który powstaje w wyniku rozpuszczania się w kroplach deszczu dwutlenku siarki, pochodzącego głównie ze spalania zasiarczonych paliw kopalnianych: węgla, gazu ziemnego oraz paliw ropopochodnych.
W warunkach laboratoryjnych kwas siarkawy można otrzymać poprzez spalanie siarki i absorpcję powstających par w wodzie, w wyniku czego powstaje niezbyt stężony roztwór tego kwasu.
Przypisy
- ↑ a b R.J.R.J. Lewis R.J.R.J., Hawley’s Condensed Chemical Dictionary, John Wiley & Sons, 2007, s. 1193, ISBN 978-0-471-76865-4 (ang.).
- ↑ a b c PradyotP. Patnaik PradyotP., Handbook of Inorganic Chemicals, London: McGraw-Hill, 2003, s. 902–903, ISBN 0-07-049439-8 (ang.).
- ↑ a b MałgorzataM. Galus MałgorzataM., Tablice chemiczne, Warszawa: Wydawnictwo Adamantan, 2008, s. 170–171, ISBN 978-83-7350-105-8 .
- ↑ a b c Sulfurous acid, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 5670 [dostęp 2023-05-19] (niem. • ang.).
- ↑ Sulfuroous Acid [online], karta charakterystyki produktu Fisher Scientific Company, 14 stycznia 2022, numer katalogowy: A307-1 [dostęp 2023-05-19] (ang.). Brak numerów stron w książce
- ↑ GeoffG. Rayner-Canham GeoffG., TinaT. Overton TinaT., Descriptive Inorganic Chemistry, Freeman & Co, 2010, s. 435, ISBN 978-1-4292-2434-5 (ang.).
- ↑ James E.J.E. House James E.J.E., Inorganic Chemistry, wyd. 2, Academic Press, 2013, s. 281–282, ISBN 978-0-12-385110-9 (ang.).
- ↑ AdamA. Bielański AdamA., Podstawy chemii nieorganicznej, wyd. 5, Warszawa: Wydawnictwo Naukowe PWN, 2002, s. 362, ISBN 83-01-13654-5 .
- ↑ Appendix E. Acidity and Basicity Constants for Weak Acids and Bases (25 °C), [w:] A.A. Blackman A.A. i inni, Chemistry, John Wiley & Sons Australia, 2012, ISBN 978-1-74246-707-8 (ang.). Brak numerów stron w książce
- ↑ a b c Norman N.N.N. Greenwood Norman N.N.N., AlanA. Earnshaw AlanA., Chemistry of the Elements, wyd. 2, Oxford–Boston: Butterworth-Heinemann, 1997, 700, 717−719, ISBN 0-7506-3365-4 (ang.).
|