|
Leptospira
Leptospira (gr. leptos czyli cienki, łac. spira czyli spiralny) – rodzaj bakterii Gram-ujemnych, należący do typu krętków. Występują gatunki pasożytnicze, saprofityczne oraz takie, które posiadają cechy obu. Leptospira mają od 6 do 20 mikrometrów długości. Posiadają dwie rzęski na obu końcach, dzięki czemu możliwe jest ich poruszanie. Są bakteriami tlenowymi. Rosną na wzbogaconych podłożach. Najlepsza temperatura do ich wzrostu to 28–30 °C. Ich nosicielami są zwierzęta, najczęściej gryzonie lub inne ssaki. Gatunki pasożytnicze wywołują leptospirozy, w których dochodzi uszkodzenia śródbłonka naczyń włosowatych i w rezultacie do uszkodzenia płuc, serca, nerek i rzadziej innych narządów. Przebieg choroby z żółtaczką jest nazywany zespołem Weila, od nazwiska Adolfa Weila, który po raz pierwszy opisał to schorzenie. Bakterie te zostały po raz pierwszy opisane w 1907 roku. HistoriaAdolf Weil w 1886 roku opisał chorobę przebiegającą z gorączką oraz uszkodzeniem wątroby, nerek i płuc[1][2], nazwaną później (1917) leptospirozą[3]. Mikroorganizm wywołujący chorobę został po raz pierwszy opisany w 1907 roku w nerce pacjenta zmarłego na żółtą gorączkę[4]. Kolejne opisy krętków pojawiały się około 1915 roku w Japonii oraz w Niemczech[2][5], podczas I i II wojny światowej, przy okazji leptospiroz pojawiających się u żołnierzy, którzy m.in. pili brudną wodę. Uważa się również, że Leptospira była powodem endemicznej choroby wśród Indian w Nowej Anglii, w latach 1616–1619[6]. Struktura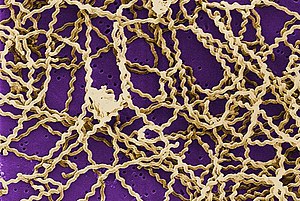 Leptospiry to cienkie, spiralne krętki[1][6][7]. Mają od 6 do 20 mikrometrów długości[1][8][9] i 0,1 mikrometra szerokości[10][9]. Zdarzają się również dłuższe osobniki[8]. Posiadają haczyk na jednym lub obu końcach[7][9]. Nadaje im to charakterystyczny kształt znaku zapytania[1]. Ruch jest możliwy dzięki dwóm periplazmatycznym rzęskom[11], które rozciągają się na całej długości bakterii i zakotwiczają się na jej końcach[1][7][9]. Niektóre zmutowane leptospiry mogą nie posiadać rzęsek[9]. Białka krętków wykazują zdolności adhezyjne do macierzy pozakomórkowej komórek gospodarza[9]. Komórki leptospir mają cechy zarówno bakterii Gram-dodatnich jak i Gram-ujemnych. Do tych pierwszych należy ścisłe połączenie błony komórkowej z mureiną, zawartą w ścianie komórkowej. Do tych drugich należy obecność lipopolisacharydu[6][9] oraz błony zewnętrznej[1]. GenomGenom zawiera od 3,9 do 4,6 Mpz. Składa się z dwóch chromosomów, oznaczanych rzymskimi cyframi I oraz II[1]. Zawiera dwa zestawy 16S i 23S rRNA i jeden gen 5S[5]. U niektórych wykryto plazmid nazwany p74, którego nie ma w leptospirach patogennych[1]. Do określania sekwencji genomu służy m.in. VNTR i MLST[12]. FizjologiaKrętki te są obligatoryjnymi tlenowcami[6][7][8]. Optymalna temperatura do ich wzrostu to 28–30 °C[6][8][10]. Rosną na podłożach wzbogaconych[10] witaminami np. B2 lub B12, kwasami tłuszczowymi oraz solami amonowymi[1][7]. Kwasy tłuszczowe są jedynym źródłem węgla i są metabolizowane poprzez beta-oksydację[1][5]. Można też wyhodować leptospiry z materiału pobranego od chorego[7]. Minimalna temperatura do wzrostu patogennych leptospir wynosi 13-15 °C. Saprofityczne krętki mogą wzrastać już przy temperaturze ok. 5 °C[13]. Są wrażliwe na wysoką temperaturę, wysychanie oraz na środki dezynfekujące[14]. Mają zdolność do tworzenia biofilmu. Dzięki tej zdolności mogą łatwiej przystosować się do warunków panujących u gospodarza czy tych w wodzie[1]. Leptospiry posiadają sfingomielinazy, hemolizyny oraz poryny[9]. Systematyka Leptospira Rodzaj Leptospira razem z rodzajami Turneria oraz Leptonema zalicza się do rodziny Leptospiraceae[9]. Obecnie stosuje się podział oparty na genotypie. Jest on stosowany od 1989[5]. W przeszłości o klasyfikacji stanowił fenotyp. Istniał wówczas podział na dwie podgrupy: Leptospira interrogans, która obejmowała wszystkie gatunki chorobotwórcze, oraz Leptospira bifleksa, łącząca wszystkie te, które nie powodowały chorób[1][8]. Wszystkie odkryte gatunki Leptospira zostały podzielone na 25 serogrup oraz 300 serotypów[1]. W 2002 Komisja Taksonomii Leptospir Międzynarodowej Unii Stowarzyszeń Mikrobiologów (International Union of Microbiological Societies) ustaliła zapis dla poszczególnych gatunków tej rodziny krętków[9]. W oparciu o analizę filogenetyczną podzielono gatunki na trzy grupy: patogenną, saprofityczną (nie jest patogenna dla ludzi) oraz grupę o cechach pośrednich[1].
Na podstawie 16S rRNA opracowano następujący kladogram[16].
EpidemiologiaKrętki te występują powszechnie na całym świecie[17]. Zakażają dwa rodzaje gospodarzy: organizmy stanowiące rezerwuar bakterii (u których bakteria zazwyczaj nie powoduje żadnych zmian chorobowych)[1] lub gospodarzy przypadkowych. Endemiczne zakażenia, które mają charakter przewlekły, dotyczą gatunków, które są naturalnymi rezerwuarami. Najczęściej są nimi gryzonie lub inne małe ssaki[15]. Mogą to być również konie, świnie, bydło[1][6][8], psy, koty, ponadto dzikie zwierzęta[1]. Obecność leptospir zazwyczaj nie wywołuje u nich żadnych objawów. Bakterie kolonizują kanaliki nerkowe i są wydalane z moczem w znacznych ilościach. Prowadzi to do skażenia wód, wilgotnej gleby oraz roślin. W środowisku zewnętrznym krętki te mogą przeżyć do 6 tygodni. Zanieczyszczona woda, rośliny lub gleba mogą stać się źródłem zakażenia dla przypadkowych gospodarzy, którymi mogą być psy, ludzie lub zwierzęta hodowlane[6][15]. Szczególnie często gospodarzem dla Leptospira są przedstawiciele myszowatych[8]. U ludzi infekcja jest zazwyczaj spowodowana aktywnością rekreacyjną lub kontaktem z zakażonymi zwierzętami[7][10]. Patogeneza Leptospiroza zwykle przebiega jako infekcja uogólniona, która u części chorych ma potencjalnie ciężki przebieg[17]. Patogenne krętki mogą powodować subkliniczne zakażenie z występującą gorączką, przypominające grypę[2]. Ciężka postać układowa nazywana zespołem Weila przebiega z uszkodzeniem nerek, wątroby, żółtaczką, niedokrwistością, gorączką i zaburzeniami świadomości[17]. Występują również krwotoki[1][10]. Często prowadzi ona do śmierci. Na przebieg choroby wpływ mają liczba i wirulencja leptospir oraz stan kliniczny i immunologiczny chorego[7][8]. Ruchliwe, cienkie leptospiry mogą przedostawać się do organizmu poprzez nieuszkodzone błony śluzowe lub przez uszkodzenia na skórze. Możliwą drogą infekcji jest również inhalacja[1]. Następnie krętki z miejsca inokulacji rozprzestrzeniają się drogą krwionośną do tkanek organizmu. Mogą też przedostać się do centralnego układu nerwowego[7][8][10]. Patogeneza zakażenia nie jest wyjaśniona, potencjalnie w patogenezie mogą brać udział mechanizmy immunologiczne, działanie toksyn i białek powierzchniowych[17]. Zazwyczaj bakterie te namnażają się w bardzo szybkim tempie, uszkadzając śródbłonek małych naczyń. Uszkodzenie naczyń może doprowadzić do krwotoków z płuc, uszkodzenia nerek i wątroby[17]. W pierwszych kilku dniach od wniknięcia leptospir można je izolować z krwi oraz płynu mózgowo-rdzeniowego. W późniejszym okresie izolacja jest możliwa z moczu[1][7][10]. W odpowiedzi na zakażenie powstają swoiste przeciwciała, które doprowadzają do usunięcia leptospir. Część objawów pojawia się pomimo eliminacji leptospir, czego przykładem tego może być zapalenie opon mózgowych, utrzymujące się, mimo nieobecności w płynie mózgowo-rdzeniowym leptospir, które są jednak są wykrywane w moczu w postaci kompleksów z przeciwciałami[7]. DiagnostykaBadanie mikroskopoweLeptospir nie można zaobserwować w mikroskopie świetlnym. Metoda Grama czy srebrzenie również nie pozwala wykryć tych krętków. Badanie mikroskopem z ciemnym polem widzenia[8][10] jest nieczułe oraz nieswoiste, co ogranicza jego zastosowanie w diagnostyce. Pomimo tego, że leptospiry w początkowej fazie infekcji obecne są we krwi, bardzo łatwo pomylić je z włóknami białek uszkodzonych erytrocytów. Do znalezienia bakterii można zastosować swoiste przeciwciała znakowane fluoresceiną[7]. HodowlaKrętki można hodować na specjalnych podłożach[8] płynnych, stałych lub półpłynnych[1] np. podłożu Flechtera lub podłożu EMJH[1][9]. Hodowlane leptospiry rosną bardzo wolno. Czas podziału komórki wynosi od 6 do 16 godzin. Wymagają około 4 miesięcznej inkubacji w temperaturze 28-30 stopni. Jednak mimo to niektóre posiewy są dodatnie już po upływie dwóch tygodni[7][10]. Leptospiry można izolować do hodowli, zgodnie z przebiegiem zakażenia, najpierw z krwi oraz płynu mózgowo-rdzeniowego, a później z moczu, gdzie są obecne nawet do 3 miesięcy. W związku z tym, że ilość leptospir w krwi oraz płynie mózgowo-rdzeniowym jest niewielka, zaleca się, by do oceny pobierać kilka próbek. Obecne we krwi oraz w moczu inhibitory wzrostu mogą znacząco opóźniać lub z całkowicie uniemożliwić izolację bakterii. Pobrany mocz musi przed badaniem zostać zneutralizowany, do uzyskania obojętnego pH, a następnie zagęszczony poprzez proces odwirowania. Na podłoże nanosi się kilka kropel osadu z obrobionego moczu. Wzrost kolonii jest kontrolowany przez mikroskop z ciemnym polem widzenia[7]. Diagnostyka molekularnaBadania mające na celu wykrycie leptospir w materiale pobranym za pomocą sond molekularnych od chorych mają małą przydatność[7]. Techniki amplifikacji kwasów nukleinowych, mimo że są skuteczniejsze, nie są obecnie dostępne do rutynowej diagnostyki. Do metod tych zalicza się m.in. PCR[15][7]. Testy serologiczneZ powodu stosowania specjalnych podłoży hodowlanych oraz długiego czasu wzrostu bakterii stosuje się w celu diagnostyki testy serologiczne, wykrywające przeciwciała. Standardową metodą jest test mikroskopowej aglutynacji z wykorzystaniem „żywych antygenów”[17][6][15][9]. Bada on zdolność surowicy chorego do aglutynacji krętków[1]. W metodzie wykrywa przeciwciała swoiste dla różnych serotypów Leptospira, dlatego laboratorium przeprowadzające badanie powinno posiadać antygeny wszystkich serotypów tych krętków. Badaną surowicę miesza się z antygenami, czyli zawiesiną z żywych bakterii. Zachodzący proces aglutynacji obserwowany jest pod mikroskopem[7]. Do rozpoznania leptospirozy konieczny jest czterokrotny wzrost miana przeciwciał[17]. Aglutyniny we krwi osób zainfekowanych leptospirami pojawiają się zazwyczaj po około 7 dniach, czasem jednak mogą minąć nawet 3 miesiące. Podczas leczenia antybiotykami poziom swoistych przeciwciał może spaść do wartości niediagnostycznych lub nieoznaczalnych[7]. Przeciwciała mogą utrzymywać się kilka lat od zakażenia, ich obecność wskazuje na zanikającą odpowiedź humoralną lub pozostałość po niezdiagnozowanym i nieleczonym zakażeniu[7]. Stosowane bywają również test makroskopowej aglutynacji szkiełkowej[17] i test ELISA[1][9]. Muszą one jednak zostać potwierdzone dodatnim wynikiem hodowli lub testu mikroskopowej aglutynacji[7]. LeczenieW leczeniu choroby o ciężkim przebiegu wykorzystuje się dożylnie benzylopenicylinę[8][10][18] lub ampicylinę[17]. W lżejszych przypadkach stosuje się też doksycyklinę lub ampicylinę. Skuteczność wykazują również cefalosporyny III generacji i azytromycyna[17]. W leczeniu objawowym wyrównuje się zaburzenia wodno-elektrolitowe, wykonuje dializoterapię w ostrej niewydolności nerek, stosuje leczenie przeciwgorączkowego[17]. Jeśli występuje nadwrażliwość na penicyliny, podaje się tetracykliny[10][17]. Doksycyklina jest również stosowana w leczeniu profilaktycznym u osób narażonych na ekspozycję leptospir[7]. Stosowane są również szczepienia przeciw leptospirom[6][7]. Początki prac nad nimi sięgają 1916. Stwierdzono wówczas, że podanie martwych krętków chroni przed infekcją[1]. Obecnie ich stosowanie jest jednak bardzo ograniczone, ponieważ występuje dużo skutków ubocznych. Szczepionka jest też skuteczna tylko przeciw serotypom w niej zawartym. Pojawienie się innego serotypu nie daje odporności organizmu, nawet w przypadku zastosowania szczepionki poliwalentnej[1]. OpornośćNie opisano oporności leptospir na antybiotyki[19]. Przypisy
Bibliografia
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
