|
Sulfure de zinc
Le sulfure de zinc désigne principalement deux corps ioniques inorganiques dimorphes, également composés de cations zinc et d'anions sulfures en proportion stoechiométrique, de formule ZnS. StructureLe chimiste et le minéralogiste distinguent nettement le sulfure de zinc alpha ZnS α, de structure hexagonale, légèrement moins dense, correspondant à la wurtzite encore improprement dénommée blende hexagonale, et le sulfure de zinc bêta ZnS β, de structure cristalline cubique, correspondant à la sphalérite ou à l'ancienne blende minérale si commune dans la nature. Il existe également ZnS γ, de structure tétragonale très rare, de couleur noire à grise, nommée polhémusite, de formule (Zn, Hg)S. Si la couleur des minéraux peut être foncée voire noire à cause de la présence d'impuretés variées, ces corps purs dimorphes, très solubles dans les acides minéraux, sont blancs à légèrement colorés. Sous une forme dense, le sulfure de zinc synthétique ZnS β d'indice de réfraction 2,368 peut être transparent et être utilisé comme fenêtre en optique visible et infrarouge. Propriétés physiques et chimiquesL'ancienne blende des chimistes ou ZnS β se présente pure au laboratoire sous l'aspect de granules blancs, insolubles dans l'eau et dans l'acide acétique. Sa masse volumique est de l'ordre de 4,1 g·cm-3 à 25 °C. Chauffée à 1 020 °C, elle subit une transition vers la forme ZnS α. Les cristaux de ZnS β cubique ou sphalérite naturelle peuvent être bruns, noirs, foncés à légèrement colorés, transparents... . Le terme blende désigne toujours les minerais sulfurés de zinc à base de ZnS β. Ils contiennent souvent du fer, du manganèse..., et parfois, mais plus rarement ou à l'état de traces, de l'or et de l'argent. Dans certains cas, ZnS β incluant des ions Ag, Cu ou Mn peuvent être légèrement phosphorescents. La concentration par flottation des minerais broyés est effectuée par l'adjonction de substances induisant des propriétés de surface spécifiques ("surfactantes" ou "tensio-actives"), car ces derniers additifs comportent des fonctions xanthate ou thiosulfate, à affinités avec les sulfures cristallins. Le ZnS α est très légèrement soluble dans l'eau, avec une solubilité de 6,9 × 10−3 g pour 1 L d'eau pure à 18 °C. Il est également insoluble dans l'acide acétique, se sublime vers 1 185 °C, et, sous une pression de 150 atmosphères, il bout à 1 850 °C. Le composé qui a deux indices de réfraction, soit 2,356 et 2,378, est phosphorescent en UV de longueur d'onde 254 nm. Il a été utilisé comme détecteur de RX, revêtement d'écran à scintillation ou écran d'ordinateur ou de TV. D'une manière générale, le solide ZnS est mis en solution par l'action des anions cyanures, générant la formation de complexe de zinc soluble en milieu aqueux basique. Quelles que soient leurs structures cristallines à coordinence 4, les sulfures de zinc peuvent montrer diverses phosphorescence à cause d'impuretés ou de lacunes, évidemment après exposition à la lumière ultraviolette ou aux RX, voire à une forte lumière bleue. En pratique, les impuretés insérées dans ces composés ZnS artificiels sont sélectionnées, et appelées activateurs (ions Cu, Ag et Au en remplacement du Zn, et P, As et Sb en remplacement du S) et coactivateurs (ions halogènes Cl, Br, I sur les sites S, et Al, Ga, In sur sites de Zn)[8]. Les bandes d'émission phosphorescentes plus ou moins durables après exposition préalable sont restreintes mais multiples dans le vert, bleu, rouge et infrarouge. PréparationsLes ions zinc sont facilement précipités en solution aqueuse par les ions sulfures, avec un produit de solubilité pKs compris entre 21,6 et 23,8. Mais il faut des conditions précises. Si l'opérateur se place en solution neutre ou alcaline, par exemple avec un sulfure d'ammonium, le précipité blanc obtenu est colloïdal, impossible à filtrer, et de ce fait, impropre à la préparation de dérivés chimiques. Afin d'obtenir un précipité cristallin aisément filtrable, il faut procéder à chaud avec du chlorure d'ammonium (solution légèrement acide).
Si l'hydrogène sulfuré gazeux (H2S) est utilisé en barbotage, il faut maintenir une acidité favorable à une précipitation plus lente par un milieu tampon acétique (pH 4) ceci avec une concentration en ions zinc à peu près centimolaire (0.01 M). Un pH plus bas limite la concentration en ions sulfures libres en solution et diminue de ce fait le degré de sursaturation de la solution. Cela permet une précipitation plus lente et donc une meilleure cristallinité du précipité obtenu.
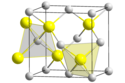
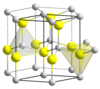
Cristallographie : deux morphologies cristallinesLe sulfure de zinc existe ainsi principalement sous deux formes cristallines, cette dualité étant souvent donnée en exemple de polymorphisme ; dans ces deux formes, la géométrie de Zn et de S est tétraédrique :
La transition entre les deux formes a lieu aux alentours de 1 020 °C. ApplicationsLe sulfure de zinc peut être employé comme pigment gris blanc, dans les peintures, les cuirs et les linoleum, les caoutchoucs ou les lithopones (pigments blancs à base de ZnS·BaSO4). Parfois il est ajouté comme charge active dans certains procédés, comme dans l'industrie du caoutchouc et des plastiques où il joue un rôle de capteur et de régulateur d'acides. Matériaux luminescentsLes sulfures de zinc préparés artificiellement, additionnés de quelques parties par million (ppm, 10−6, mg/kg) d'activateur(s) adéquat(s) et éventuellement de co-activateur(s), sont utilisés comme luminophores dans de nombreuses applications : tube cathodique, écrans à rayons X, produits phosphorescents, etc. En général, la phosphorescence efficace ne dure que quelques heures et rend une lumière principalement verte, jaune, orange... Lorsque l'argent est utilisé comme activateur, la couleur résultante est un bleu brillant avec un maximum d'émission à 450 nanomètres. Le manganèse quant à lui produit une couleur rouge-orangé autour de 590 nanomètres et le cuivre donne une lueur verdâtre à longue durée de vie typique des objets brillants dans le noir. Le sulfure de zinc dopé au cuivre est également utilisé pour les panneaux électroluminescents[9]. Il est aussi largement utilisé comme scintillateur pour détecter les rayonnements ionisants ou comme ou détecteur de rayons X. Associés à des produits colorants organiques, ZnS permettait autrefois de fabriquer des peintures luminescentes sous léger éclairage UV continu, cette fois-ci par effet global de fluorescence. HistoriqueLa phosphorescence du ZnS α a été rapportée la première fois par le chimiste français Théodore Sidot en 1866. Ses découvertes furent présentées par Edmond Becquerel, qui obtint une partie de sa renommée pour ses recherches sur la luminescence[10]. En 1930, René Coustal[11] parvient à produire un sulfure de zinc très phosphorescent grâce à la méthode dite « par explosion ». Le sulfure de zinc a ensuite été utilisé par Ernest Rutherford et d'autres chercheurs durant les premières années de la physique nucléaire comme scintillateur, émettant de la lumière sous excitation de rayons X ou de rayons cathodiques, le rendant utile pour des écrans à rayons X et des tubes cathodiques[12]. Notes et références
Bibliographie
Voir aussiArticles connexesLiens externes |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||