Chemical compound
Il difenilzinco è un composto chimico di formula C12H10Zn che in condizioni normali si presenta come un solido bianco.[1] In sintesi organica, è utilizzato come reagente per funzionalizzare molecole con l'inserimento di un gruppo fenile, come può avvenire nella reazione di Michael, in cui svolge il complito di nucloefilo (cosiddetto donatore di Michael), o nella reazione di Neghishi.
Sintesi
Il difenilzinco è disponibile in commercio e, generalmente, lo si può sintetizzare con tre metodi differenti.

- Transmetallazione da un reattivo di Grignard. Viene condotta facendo reagire un alogenuro di zinco con un composto di Grignard. A titolo di esempio, è possibile citare la reazione sottostante tra il bromuro di fenilmagnesio e il cloruro di zinco.

- In accordo alla teoria HSAB, entrambe le reazioni di transmetallazione presentano l'equilibrio di reazione spostato verso la formazione dei prodotti.
- Ossidoriduzione con zinco metallico. Questo metodo prevede la formazione del composto tramite una reazione con buone rese a partire da difenilmercurio, che può reagire con un eccesso di zinco in diverse condizioni.[4][1] La formazione dei prodotti è favorita dal potenziale di riduzione del mercurio, notevolmente superiore a quello dello zinco: in acqua circa +0,8 V vs –0,74 V.
Caratteristiche strutturali e fisiche
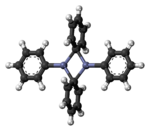
Il difenilzinco isolato esiste come dimero PhZn(μ-Ph)2ZnPh allo stato solido (e non solvatato).[5]
Il difenilzinco è un composto organico dello zinco ed è considerato l'equivalente sintetico di un sintone feniluro (Ph-).
La relativa stabilità del composto è dovuta all'impossibilità intrinseca di subire due reazioni di decomposizione tipiche invece degli alchili dei metalli di transizione: l'α–eliminazione di idruro metallico (a sua volta spesso instabile), poiché non ci sono idrogeni sul carbonio legato a Zn), e soprattutto la β–eliminazione, poiché produrrebbe un intermedio di natura benzinica estremamente instabile.
Il composto è infatti termicamente stabile (punto di ebollizione 280-285°alla pressione atmosferica di 760 mmHg), tuttavia è sensibile all'aria ed all'umidità.
Note
- ^ a b (EN) Guillaume Pelletier, Diphenylzinc, in Encyclopedia of Reagents for Organic Synthesis, Chichester, UK, John Wiley & Sons, Ltd, 2013, DOI:10.1002/047084289x.rn01548, ISBN 978-0-471-93623-7.
- ^ (EN) Julia E. Fleckenstein e Konrad Koszinowski, Lithium Organozincate Complexes LiRZnX 2 : Common Species in Organozinc Chemistry, in Organometallics, vol. 30, n. 18, 26 settembre 2011, pp. 5018–5026, DOI:10.1021/om200637s. URL consultato il 4 agosto 2024.
- ^ David Y. Curtin e John L. Tveten, Reaction of Diarylzinc Reagents with Aryldiazonium Salts. Direct Formation of cis-Azo Compounds, in J. Org. Chem., vol. 26, n. 6, 1961, pp. 1764, DOI:10.1021/jo01065a017.
- ^ P Markies, Gerrit Schat, Otto S. Akkerman, F. Bickelhaupt e Anthony L. Spek, Complexation of diphenylzinc with simple ethers. Crystal structures of the complexes Ph2Zn·glyme and Ph2Zn·diglyme, in J. Organomet. Chem., vol. 430, 1992, pp. 1–13, DOI:10.1016/0022-328X(92)80090-K.
- ^ Peter R. Markies, Gerrit Schat, Otto S. Akkerman, Friedrich Bickelhaupt, Wilberth J. J. Smeets e Anthony L. Spek, Coordinational behavior of solvent-free diorganylzinc compounds: the remarkable x-ray structure of dimeric diphenylzinc, in Organometallics, vol. 9, n. 8, 1990, pp. 2243, DOI:10.1021/om00158a022.
Altri progetti
 Portale Chimica
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia