|
Etano
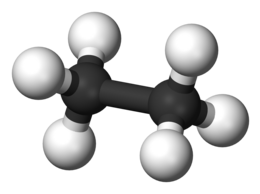
L'etano è l'unico alcano con due atomi di carbonio; è un idrocarburo alifatico, il secondo nella serie degli alcani, di formula molecolare C2H6, o anche (CH3)2. In esso il carbonio ha stato di ossidazione -3, a differenza che nel metano (-4). Può essere considerato il dimero del radicale metile (H3C•); il gruppo alchilico che da esso deriva è l'etile (C2H5–). A temperatura e pressione ambiente è un gas[2] estremamente infiammabile, esplosivo in miscela con l'aria, incolore, inodore e atossico. Presenza in natura ProduzioneIndustrialmente si ottiene per distillazione frazionata del gas naturale, di cui è uno dei principali componenti, insieme al metano. Nelle raffinerie di petrolio è presente nei gas incondensabili in testa alle colonne di distillazione. Può essere ottenuto anche per riduzione dell'etino e dell'etene (idrogenazione catalitica con catalizzatore a base di Pd-C) In laboratorio può essere ottenuto per elettrolisi (elettrolisi di Kolbe) dell'acido acetico: ApplicazioniNell'industria chimica, è la materia prima per la produzione dell'etene per cracking catalitico. Struttura molecolareGli atomi di carbonio hanno solo quattro legami semplici e sono quindi ibridati sp3; ciascuno di essi ha attorno a sé l'altro carbonio e tre idrogeni in un ambiente tetraedrico. La struttura di equilibrio della molecola dell'etano in fase gassosa è stata studiata attraverso la spettroscopia rotazionale nella regione delle microonde e con la tecnica della diffrazione elettronica. Sono così state ricavate distanze ed angoli di legame con notevole precisione. Dalle microonde risulta: r(C-C) = 152,8(3) pm; r(C-H) = 108,8(5) pm; ∠CCH = 111,6(5)°; dalla diffrazione elettronica: r(C-C) = 152,4(3) pm; r(C-H) = 108,9(5) pm; ∠CCH = 111,9(5)°;[3] (in parentesi le incertezze sull'ultima cifra). ConformazioniLa rotazione attorno ad un legame semplice è in genere possibile, anche se questo implica per la molecola superare una barriera energetica (tensione torsionale). Nell'etano a temperatura ambiente e anche molto minore la barriera per la rotazione dei metili attorno all'asse del legame C–C è relativamente piccola, circa 12 kJ/mol, il che permette alla molecola di etano di assumere tutte le conformazioni possibili tra due estreme in funzione dell'angolo di rotazione (angolo di torsione[4]). La conformazione detta eclissata, con l'angolo diedro HCCH di 0°, è la meno stabile ed ha simmetria D3h;[5] quella detta sfalsata, con l'angolo diedro HCCH di 60°, è la più stabile (è il minimo di energia potenziale) ed ha simmetria D3d.[5] L'instabilità della forma eclissata deriva principalmente dalla reciproca repulsione degli elettroni di legame (legami C-H) che in questa conformazione sono disposti reciprocamente a distanze minime e in parte dalle repulsioni dei nuclei degli atomi di idrogeno, che non hanno gusci sottostanti di elettroni.[6] Tuttavia, la situazione sembra essere più complessa[7] e nella stabilizzazione della forma sfalsata gioca un ruolo non proprio secondario l'iperconiugazione.[8][9] A temperatura ambiente la rotazione è praticamente libera e la forma sfalsata prevale sulla eclissata per il 99%.
Note
Altri progetti
Collegamenti esterni
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||