|
N-Ossido di N-metilmorfolina
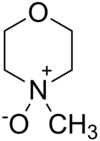
L'N-ossido di N-metilmorfolina è un composto organico eterociclico avente formula semistrutturale O(CH2CH2)2N+(CH3)−O−. È usato in chimica organica come coossidante e catalizzatore sacrificale nelle reazioni di ossidazione, ad esempio quelle effettuate con tetrossido di osmio,la diidrossilazione asimmetrica di Sharpless, o quelle realizzate tramite il perrutenato di tetrapropilammonio (n-C3H7)4N+ RuO4− (TPAP) come reattivo. È conosciuto anche con le sigle NMMO e NMO ed è commercializzato sia anidro che monoidrato[3]. Struttura e proprietàL'N-ossido di N-metilmorfolina a temperatura ambiente si presenta, in forma pura, come cristalli incolori e igroscopici, leggermente solubili in acqua,[4] ma ne esistono forme idrate, tra cui il monoidrato e il 2,5-idrato.[5] Si scioglie bene in dimetilsolfossido, poco in metanolo.[6] Come in generale per gli N-ossidi delle ammine terziarie, anche questo è un composto basico: il pKa del suo acido coniugato è riportato come 4,75,[7] il che corrisponde a un pKb di 9,25. L'N-ossido di N-metilmorfolina è una molecola zwitterionica il cui anello ha la conformazione del cicloesano a sedia, dove l'atomo di ossigeno esociclico è in posizione assiale, mentre il gruppo metile è in posizione equatoriale. Per quanto riguarda l'impaccamento molecolare, le molecole sono disposte in maniera tale che i legami N−O di molecole vicine siano antiparalleli, riducendo così al massimo le interazioni tra di essi.
Nella forma monoidrata le molecole di acqua sono disposte in maniera tale da orientare le molecole di NMMO lungo un asse, come in un polimero. In questo modo le zone idrofobiche e idrofile sono nettamente distinte. Essendo le interazioni tra le zone idrofile e idrofobe molto deboli, questi strati possono muoversi ciascuno rispetto agli altri. Da notare che l'atomo di ossigeno facente parte del ciclo non ha alcun ruolo in tali interazioni, infatti la cellulosa è solubile anche in N-ossido di N-metilpiperidina in cui l'atomo di ossigeno è sostituito da un metilene (CH2).[8] UtilizziSolvente della cellulosaLa forma monoidrata è usata come solvente per la cellulosa nel processo Lyocell di produzione delle fibre di cellulosa. Usando NMMO contenente il 5% di acqua riscaldata a 100 °C è in grado di disciogliere cellulosa ad alto peso molecolare fino ad una concentrazione del 30%. Quella che si ottiene non è una vera e propria soluzione ma una mesofase anisotropa facilmente orientabile che in inglese viene chiamata dope. Riprecipitando questa soluzione in un bagno di acqua si ottengono fibre e film. La quantità di cellulosa disciolta dipende da:
Il processo è molto simile, ma non analogo, al processo di produzione della viscosa. In quest'ultimo, la cellulosa viene resa solubile convertendola nei suoi derivati xantati. Utilizzando l'NMMO, invece, la cellulosa viene solubilizzata senza alcuna trasformazione. Le fibre risultanti sono simili alla viscosa. La diluizione con acqua causa la riprecipitazione della cellulosa, quindi il processo di dissoluzione della cellulosa è sensibile alla presenza dell'acqua. Essendo l'NMMO un ossidante, le soluzioni "dope" sono sensibili a tutte le impurità di tipo catalitico. A causa di impurità come ioni di metalli di transizione (soprattutto ferro e rame), possono avvenire reazioni secondarie che portano alla degradazione della cellulosa e alla formazione di N-metilmorfolina, morfolina e formaldeide. Per questo motivo devono essere usati additivi stabilizzanti. Il più conosciuto è il gallato di propargile che però causa un'intensa colorazione.[5] Altri additivi sono fosfati, basi, fenoli stericamente ingombranti e riducenti deboli[10]. La cellulosa è insolubile nella maggior parte dei solventi a causa della sua forte rete di legami idrogeno intermolecolari resistenti ai solventi. L'NMO è in grado di rompere questa rete di legami (infatti vengono a crearsi legame idrogeno tra la cellulosa e l'NMmO) e, di conseguenza, di solvatare la cellulosa. Si riesce a ottenere lo stesso risultato con pochi altri solventi, in particolare con una miscela di cloruro di litio in dimetilacetammide[11][12] e alcuni liquidi ionici idrofili[13]. Industrialmente l'NMMO è preferito agli altri solventi della cellulosa in quanto dopo l'uso può essere riciclato fino al 99%. Dissoluzione di scleroproteineL'NMMO è anche utilizzato per la solvatazione di scleroproteine (trovate nei tessuti animali). La dissoluzione avviene nelle zone più omogenee dei cristalli e che contengono principalmente residui di glicina e alanina. Il meccanismo di questa dissoluzione non è ancora ben approfondito. Alcuni studi hanno mostrato un comportamento simile ad altri sistemi ammidici, ad esempio ad esapeptidi. Ne è risultato che l'NMMO è in grado di rompere i legami idrogeno delle ammidi. Ossidante L'NMMO è un ossidante in quanto N-ossido. È utilizzato come ossidante stechiometrico per rigenerare il catalizzatore principale dopo che questo è stato ridotto dal substrato. Per esempio, il tetrossido di osmio, se usato in quantità stechiometrica, è in grado di ossidare gli alcheni a dioli vicinali sin. Per limitare le quantità di tetrossido di osmio (molto costoso e tossico), si usa come ossidante l'NMMO in quantità stechiometrica e una quantità catalitica di tetrossido di osmio. Tale reazione è nota come diidrossilazione di Upjohn.[14] Note
Altri progetti
Information related to N-Ossido di N-metilmorfolina |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||