|
Pentafluoruro di platino
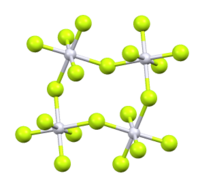
Il pentafluoruro di platino o fluoruro di platino(V) è il composto binario di formula PtF5. È uno dei pochi composti dove il platino ha stato di ossidazione +5 (altri esempi sono quelli contenenti l'anione PF6− come O2PtF6 e XePtF6).[1] Struttura molecolarePtF5 ha una struttura tetramerica analoga ai pentafluoruri di rutenio e osmio. Ogni atomo di platino ha coordinazione ottaedrica, con due leganti fluoruro a ponte.[2] PtF5 cristallizza nel sistema monoclino, gruppo spaziale P21/c, con costanti di reticolo a = 552 pm, c = 1243 pm e β = 99,98°, con 4 unità di formula per cella elementare.[3] SintesiIl composto fu sintetizzato per la prima volta da Neil Bartlett nel 1960.[4] PtF5 si può ottenere tramite fluorurazione controllata ad alta temperatura e sotto pressione:[1]
oppure per reazione tra dicloruro di platino e fluoro a 350 °C:[5]
ReattivitàPtF5 è uno degli ossidanti più forti conosciuti. È stato usato per ossidare O2 a O2+[PtF6]− e Xe a XePtF6.[2] Reagisce violentemente in acqua ossidandola a ossigeno:[1]
Per riscaldamento disproporziona a PtF4 e PtF6:[5]
NoteBibliografia
Information related to Pentafluoruro di platino |
||||||||||||||||||||||||||||||