四种磷 的常见同素异形体 磷 的同素异形体 2 分子与磷原子。
磷的同素异形体转化关系图
磷的同素异形体的性质[ 1] [ 2]
形态
白磷(α)
白磷(β)
紫磷
黑磷
红磷
晶系
体心立方
三斜
单斜
正交 、三方、面心立方 、无定形
无定形
皮尔逊符号
aP24
mP84
oS8
-
空间群
I4 3m
P1 No.2
P2/c No.13
Cmca No.64
-
密度 (g/cm3 )
1.828
1.88
2.36
2.69
2.0 ~ 2.4
能隙 (eV)
2.1
1.5
0.34
折射率
1.8244
2.6
2.4
白磷样品 白磷分子 把白磷溶於二硫化碳 ,再把溶液灑在紙上。二硫化碳揮發後留下白磷,白磷在空氣中自燃,令紙張燒焦。 白磷 (因商品白磷常带黄色,故又稱為黄磷 [ 3] :180 ),分子式P4 ,为白色固体,质软。白磷有剧毒 ,致死量为50mg[ 4] :422 。不溶于水,溶于大多数有机溶剂[ 4] :422 。常温下为立方晶系 的α-型,具体结构仍未知,熔点为44.1℃。-77℃一以下转化为六方晶系的β-型,密度1.88g/cm3 。[ 4] :422 可用於製造磷酸 及肥料 。实验室置于冷水中保存。常用于化学武器 。34°C时可在空气中自燃 ,生成白色烟雾,主要成分为五氧化二磷 (烟)以及五氧化二磷于空气中水结合生成的磷酸 (雾)。
白磷弹 是利用了白磷在空气中自燃特性的化学武器 ,曾被当作燃烧弹使用,但后来由于對交战国士兵造成的巨大身体及心理创伤而逐渐被各国弃用,转而作为目标指示弹及烟雾弹使用。
过去,不慎误服白磷后常用硫酸铜 溶液洗胃,原因是白磷和硫酸銅溶液會發生如下反應:
11
P
4
+
60
C
u
S
O
4
+
96
H
2
O
→
20
C
u
3
P
+
24
H
3
P
O
4
+
60
H
2
S
O
4
{\displaystyle \mathrm {11P_{4}+60CuSO_{4}+96H_{2}O\rightarrow 20Cu_{3}P+24H_{3}PO_{4}+60H_{2}SO_{4}} }
但是,硫酸铜有毒,会损害肾脏和大脑。目前,在美国等国家已经不再使用。在一本美国海军编制的手册中則推荐使用碳酸氢盐溶液来中和磷酸。[ 5]
紅磷的外觀 红磷的结构 紅磷 是磷 的一種同素異形體 ,因呈紅色而得名。
“红磷”一词可以指代所有带红色的磷,故其具有多种晶型 ,它们的密度介于2.0-2.4g/cm3
之间,熔点介于585-610℃之间。红磷在许多溶剂中都很难溶解,不能自燃,也基本没有毒性。[ 4] :424
将白磷加熱至400℃以下或用紫外光照射白磷即可獲得紅磷,在硫 、碘 或钨丝 的催化下加热可以加快转化速率[ 3] :183-184 。紅磷的結構屬多分子不規則排列。
可當火柴 摩擦面。
在俄羅斯 和前蘇聯地區,紅磷是一種監控物質,因為紅磷可用作非法生產安非他命 類的興奮劑 。
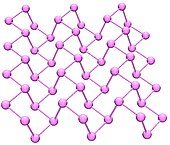
黑磷结构的球棍模型 黑磷的結構 黑磷 是一种有金属 光泽的晶体 ,是磷的同素异形体中密度最大、热力学最稳定以及性质最不活泼的一种。它是高聚 的不溶性固体。[ 4] :422 它是用白磷 在很高压强 (12,000大氣壓)和较高温度 (200℃)下转化而形成的。
目前已知的黑磷有四种晶系:正交、三方、面心立方和无定形[ 4] :422 。三方黑磷是由许多层聚合的六元环组成,类似石墨 。正交黑磷的结构类似于有“褶皱”的六元环所组成。面心立方黑磷中每个磷原子都处于6个其他磷原子组成的八面体 中心。高压下,正交黑磷会可逆地转变为三方和面心立方黑磷。[ 4] :423 无定形的黑磷在125°C时开始向红磷 转变。
黑磷具有像石墨 的片状结构和導電性,黑磷晶体有一些本质特征:如晶体内不仅有共价键 ,还有离子键 和范德华力 。
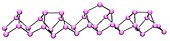
紫磷(右)与红磷(左)的对照图 紫磷的结构 紫磷结构的球棍模型 紫磷 为单斜晶系,又名希托夫磷 。此分子的结构较为复杂,每个磷原子的三条键呈三角锥,互相堆积成为管状结构,并排列为双层。每两层又垂直地堆积形成三维结构。[ 4] :423
紫磷加熱至300°C才能在空氣中被點燃,不溶於所有的溶劑,具有金屬光澤,因此雖非金屬卻稱作金屬磷。
紫磷可透過把白磷以500°C溶解在盛有熔融的鉛 的密封管中18小時製得。此外,透過在一密封管中以530°C加熱紅磷,密封管的上半部維持在444°C,亦可製得紫磷結晶。
若紫磷在一充滿不活潑氣體中(如氮氣或二氧化碳)被加熱則會昇華 ,得出的氣體會凝華 為白磷。[來源請求]
环状的磷在 2007年被预测。[ 6] 8 和23个P2 单元组成,共230个磷原子,邻近的两个磷环的距离为 6.4 Å。[ 7]
P6
于2016年,通过分子束外延 的方法用黑磷作为前体,开始生产一层的蓝磷。 [ 8]
二磷的结构 二磷分子 二磷 分子 (P2 ) 可以在极端条件下产生 (例如1100开氏度下的 P4 ) 。 2006年,在正常条件下,人们发现使用某些过渡金属 的配合物 (例如,钨 和铌 的配合物)就可以在均质溶液中产生二磷分子。 [ 9]
二磷是磷 的气态形式,在 1200 °C 至 2000 °C 下热稳定。 白磷分子(P ) 在低温就开始分解成二磷并形成平衡。 P 分子在 800 °C 下的浓度是 ≈ 1%。 到了 2000 °C以上,二磷分子会分解成自由磷原子。
^ A. Holleman, N. Wiberg. XV 2.1.3. Lehrbuch der Anorganischen Chemie 33. de Gruyter. 1985. ISBN 3-11-012641-9 ^ Berger, L. I. Semiconductor materials . CRC Press. 1996: 84. ISBN 0-8493-8912-7 ^ 3.0 3.1 张青莲. 无机化学丛书 第四卷. 1995-01-01. ISBN 9787030305480 ^ 4.0 4.1 4.2 4.3 4.4 4.5 4.6 4.7 麦松威.周公度.李伟基. 高等无机结构化学. 2001-07. ISBN 9787301047934 ^ US Navy's Treatment of Chemical Agent Casualties and Conventional Military Chemical Injuries: FM8-285: Part 2 Conventional Military Chemical Injuries . [2009-05-05 ] . (原始内容 存档于2005-11-22). ^ Karttunen, Antti J.; Linnolahti, Mikko; Pakkanen, Tapani A. Icosahedral and Ring-Shaped Allotropes of Phosphorus. Chemistry - A European Journal. 15 June 2007, 13 (18): 5232–5237. PMID 17373003 doi:10.1002/chem.200601572 ^ Zhang, Jinying; Zhao, Dan; Xiao, Dingbin; Ma, Chuansheng; Du, Hongchu; Li, Xin; Zhang, Lihui; Huang, Jialiang; Huang, Hongyang; Jia, Chun-Lin; Tománek, David; Niu, Chunming. Assembly of Ring-Shaped Phosphorus within Carbon Nanotube Nanoreactors. Angewandte Chemie International Edition. 6 February 2017, 56 (7): 1850–1854. PMID 28074606 doi:10.1002/anie.201611740 ^ Zhang, Jia Lin; Zhao, Songtao and 10 others. Epitaxial Growth of Single Layer Blue Phosphorus: A New Phase of Two-Dimensional Phosphorus. Nano Letters. 30 June 2016, 16 (8): 4903–4908. Bibcode:2016NanoL..16.4903Z PMID 27359041 doi:10.1021/acs.nanolett.6b01459 ^ Piro, Na; Figueroa, Js; Mckellar, Jt; Cummins, Cc. Triple-bond reactivity of diphosphorus molecules. Science. 2006, 313 (5791): 1276–9. Bibcode:2006Sci...313.1276P PMID 16946068 doi:10.1126/science.1129630