|
Lewisite
La lewisite (2-chlorovinyldichlorarsine) est un composé organique de l'arsenic (arsine halogénée), qui se présente comme un liquide huileux, utilisé comme agent toxique de guerre lors de la Première Guerre mondiale et la guerre sino-japonaise (1937-1945). Elle fait partie — comme l'ypérite — de la catégorie des vésicants ; elle irrite puis attaque et détruit l'épiderme ou les muqueuses des voies aérorespiratoires ou digestives et qui brûle et érode la cornée et la face interne des paupières[6],[7]. La lewisite produit des symptômes proches de ceux de l'ypérite, mais plus graves, cicatrisant moins bien, et qui surtout apparaissent très vite (quelques minutes en se développant sur plusieurs dizaines d'heures ensuite) après l'exposition, handicapant plus rapidement les victimes. C'est un produit non-inflammable qui, lorsqu'il est dispersé sous forme d'aérosol ou de gaz, pénètre facilement au travers des vêtements et qui passe même au travers du caoutchouc naturel (latex, composant des premiers masques à gaz). On a commencé à la produire massivement comme arme chimique à la fin de la Première Guerre mondiale, en 1918, ce qui fait qu'une grande partie des stocks accumulés à l'époque n'ont pas ou peu servi. Ils ont pour une grande partie été jetés en mer où ils conservent un potentiel de nuisance. On en fait encore un usage médical (pour tuer des cellules cancéreuses dans certaines chimiothérapies). Leur détention sans autorisation et contrôle est interdite.
Le nom « lewisite » vient de celui de son inventeur, chimiste et militaire Winford Lee Lewis (1878-1943).
Types de lewisiteOn distingue habituellement 3 types de lewisites :
HistoireC'est dans la thèse universitaire d'un jeune chimiste Julius Arthur Nieuwland (en) du Maloney Hall, un laboratoire de chimie de l'Université catholique d'Amérique (Washington, D.C.) que Winford Lee Lewis, chimiste de l'armée américaine, a trouvé (début 1918 ?) la formule nécessaire à la synthèse de ce produit toxique (nécessitant la présence d'acide chlorhydrique et de mercure). L'armée américaine l'a développé comme arme secrète au Nilo Park (centre situé à Cleveland, Ohio[8]) en l'appelant d'abord « the new G-34 » pour confondre son développement avec celui de l'ypérite (ou gaz moutarde). Secrètement, le capitaine James Bryant Conant a reçu l'ordre d'en préparer la production industrielle à grande échelle. Cet ancien professeur de chimie de l'université Harvard avait été nommé directeur de l'Unité de recherche « Organic Research Unit No. 1 ».  La lewisite ne semble pas avoir été utilisée lors de la « grande guerre » par les États-Unis, mais elle a au moins été expérimentée dans les années 1920 sous le nom de Dew of Death (« rosée de la mort »)[9]. Les américains s'y seraient spécialement intéressé car ininflammable et active en milieu froid. Il a été alors désigné par le sigle M1 lors de la Seconde Guerre mondiale avant d'être nommée « L » par l'OTAN. Usages militaires : Les lewisites ont été utilisées à partir de 1918, seules ou en mélanges avec de l’ypérite au soufre (mélange parfois dit « HD ») pour en abaisser le point de fusion, afin de « mieux » vaporiser le produit à température ambiante. C'est un produit qui a été fabriqué dans les grands pays industriels en grande quantité, au moins jusqu'en 1943. Les États-Unis en auraient produit au moins environ 20 000 tonnes, qui ont été conservées en raison de la possibilité de l'utiliser comme antigel pour le gaz moutarde ou pour mieux faire pénétrer ce dernier au travers des vêtements de protection dans certaines situations particulières. Il a été remplacé par la variante dite « HT » du gaz moutarde ; un mélange 60/40 de gaz moutarde soufré et de O-moutarde(T)), déclaré obsolète dans les années 1950. Certains stocks de lewisite ont été neutralisés à l'eau de javel et jetés dans le Golfe du Mexique[10] et d'autres stocks immergés au large de la Crimée après la Seconde Guerre mondiale par l'URSS[11]. Selon les usines, pays et époques de fabrication ou modes de stockage, elle contient diverses impuretés et aussi des additifs chargés de le stabiliser ou d'en renforcer la toxicité ou le pouvoir vulnérant. Effets psychologiques : les impacts des gaz ont fortement impressionné les belligérants qui les ont subis et ceux qui en ont entendu parler, au point qu'ils ont ensuite été peu utilisés alors que d'énormes stocks en avaient été accumulés. Après la grande guerre, de nombreux journaux ont publié des articles exagérant même les impacts de la lewisite. Ainsi, le Cleveland Plain Dealer le citait la lewisite comme étant soixante-deux fois plus puissante que l'ypérite, et susceptible de tuer un adulte à raison d'une seule goutte sur la main. Le , un article du Journal de San-Francisco estimait que la lewisite pourrait stériliser un terrain au point que rien ne pourrait y pousser au moins deux ans et peut-être plus longtemps[12], ce qui semble a posteriori vérifié sur certains sites de séquelles de guerre, mais où les doses ont été extrêmes (démantèlement d'obus chimiques), sur la place à gaz de Verdun par exemple. Après des essais en milieu naturel, cette arme a ensuite été abandonnée par les États-Unis probablement en raison d'une dégradation trop rapide en condition humide (pluie, brume...), d'une odeur trop repérable, mais aussi peut-être en raison d'une rémanence trop importante du produit en condition sèche (dans un environnement bâti par exemple) et du fait que, comme de nombreuses armes chimiques, il puisse se retourner contre celui qui l'utilise, ainsi peut-être qu'une toxicité environnementale importante et des conséquences éthiquement inacceptables ont fait que les stocks importants ont peu été utilisés après 1918. DescriptionÀ température ordinaire la lewisite pure est incolore, mais elle est rarement pure. On la trouve de couleur ambrée à brun ou vert foncé. Elle reste à l'état liquide dans l'eau froide en raison de sa température de fusion qui est très basse (−18 °C) ce qui en fait un toxique plus « efficace » dans les pays froids en hiver que l'ypérite (inactive en dessous de 6 °C). Elle est également toxicologiquement plus « efficace » dans les pays chauds (où elle est mieux vaporisée dans l'air). Mélangée avec l'ypérite, elle prend la consistance du miel. Pure, la lewisite est presque inodore, mais les impuretés qu'elle contient habituellement, dues à ses modes de fabrication ou d'utilisation lui confèrent une odeur d’essence de géranium (en réalité : pélargonium, souvent confondu avec le géranium), qui durant la guerre devait alerter les soldats (port du masque à gaz et d'une tenue de protection). Dégradabilité
La lewisite n'est pas en tant que telle bioaccumulable et ne se concentre donc pas dans la chaîne alimentaire[13], mais l'arsenic qu'elle contient et relargué lors de sa décomposition n'est pas dégradable et il peut facilement être reconcentré par le réseau trophique après sa dispersion dans l'environnement. Les champignons, les organismes filtreurs peuvent le concentrer. Dans l'organisme humain :
Toxicologie (Toxicité pour l'Homme)Comme pour l'ypérite, on peut distinguer trois grands types d'exposition :
Dans les trois cas, le produit pénètre rapidement au travers de la peau et encore plus vite les muqueuses humides (des poumons, de l'œil ou du tractus digestif). Alors que les symptômes les plus graves ne se manifestent parfois qu'après une dizaine d'heures avec l’ypérite, la lewisite a des effets bien plus rapides mais aussi bien plus toxiques que l'ypérite : 35 mg suffisent pour tuer 50 % des personnes touchées, où il en faut 100 pour l'ypérite[3]. La CTL 50 (dose inhalée tuant 50 % des personnes respirant cet air, mesurée en milligrammes par minute et par mètre cube d'air) est de 1 500 mg/min/m3, c'est autant que l'ypérite. Mais la lewisite est deux fois plus mortelle de ce point de vue que le phosgène (3 200 mg/min/m3). Elle est en outre plus de sept fois plus volatile que l'ypérite (4 500 mg/m2 à 25 °C) contre 625 pour l'ypérite. Ceci devenant encore plus vrai quand la température diminue. En dessous de 6 °C, l'ypérite n'est plus active, sauf en contact direct avec la peau qui la réchaufferait. L'effet toxique : il est violent et de type allergique (œdème, cloques (phlyctènes), rougeurs, larmoiements, prurit) mais encore mal expliqué (selon les données publiquement disponibles, souvent classées confidentielles ou parfois contradictoires). Il combine probablement synergiquement les effets vésicants du dérivé halogéné (chloré) de l’arsine aux effets toxiques de l'arsenic qui peuvent porter sur de nombreux organes, et qui sont sans doute fortement exacerbés par la destruction des muqueuses et un choc anaphylactique. L'arsenic trivalent As3+, extrêmement toxique, semble expliquer le fait que l'action de la lewisite est plus dure et plus rapide que celle de l'ypérite. Cette forme d'arsenic inhibe de nombreuses enzymes à groupements thiols (-SH), dont l'hexokinase et la pyruvate déshydrogénase (en jeu dans le métabolisme énergétique). La pyruvate comporte un acide lipoïque qui est une des cibles chimiques de la molécule de lewisite. En cas de passage dans le sang, la lewisite cause des dommages sur la moelle osseuse et une perte de liquide des vaisseaux sanguins, ce qui peut entraîner une chute de tension artérielle et des dommages indirects pour l'ensemble des organes, voire la mort, d'autant que ces dégâts induisent une déplétion immunitaire favorisant les pathogènes opportunistes. Cancérogénicité : ce produit ne figure pas sur la liste des cancérigènes avérés, mais il n'a pas non plus fait l'objet d'études de cancérogénicité. Le Département de la Santé et des Services sociaux des États-Unis (DHHS), le Centre international de recherche sur le cancer (CIRC), et l'EPA ont classé l'ypérite seule comme une substance cancérigène pour l'homme, mais on ignore si la lewisite ou le mélange gaz moutarde-lewisite sont ou ne sont pas cancérigènes pour l'homme. On ignore aussi si les enfants y sont plus sensibles que les adultes, s'il existe des susceptibilités individuelles ou génétiques, et s'il s'agit d'un produit posant problème pour le développement[14], faute d'études et de données disponibles. Il est probablement cancérigène, au moins en raison de l'arsenic qu'il contient qui lui est un cancérigène reconnu. Reprotoxicité : il semble ne pas y avoir eu d'études visant à étudier chez l'homme un éventuel impact sur la reproduction, du gaz moutarde ou de la lewisite, ou du mélange de ces deux toxiques. SymptomatologieL'intoxication se manifeste généralement d'abord par une irritation nasale et une sensation de brûlure des yeux, de la peau et de l’appareil respiratoire. La victime est aussi atteinte de douleurs oculaires qui précèdent et accompagnent un blépharospasme quasi immédiat et suivi d'une forte conjonctivite et d'un œdème des paupières. Les symptômes qui suivront sont comparables à ceux de l’ypérite, en plus rapide : les difficultés respiratoires et l'œdème des poumons apparaissent rapidement :
L'arsenic combiné au chlore est source d'une intoxication systémique qui se manifeste par :
... le tout contribuant à un « état de choc » pouvant être létal. Traitement symptomatiqueLe traitement sera identique à celui contre l'ypérite, avec les différences suivantes liées au fait que la lewisite pénètre encore plus rapidement l'organisme que ne le fait l’ypérite :
Effets secondaires : le traitement combiné aux effets de l'intoxication peuvent provoquer (dès les premières heures) de nombreux effets, tous réversibles (tachycardie, hypertension artérielle aiguë, anxiété, nausée, vomissements, sensation de brûlure au niveau des mains, du visage, de la bouche, hypersialorrhée, rhinorrhée, hypersudation, hypersécrétion lacrymale, …).
À l'avenir, la greffe cutanée de cellules souches et la dermoabrasion contrôlée pourraient améliorer la réparation des lésions cutanées de la lewisite et d'autres vésicants[17]. Traitement par l'hypothermie : il semble pouvoir réduire les effets de l'exposition, mais aussi améliorer les traitements conventionnels chez les victimes de la lewisite (d'après des tests sur culture de peau humaine et chez le cobaye)[18],[19]. Les personnes à risqueLes militaires, les démineurs, les personnels civils travaillant dans des sites militaires ou là où de tels composés sont stockés, mais aussi des pêcheurs en mer, des agriculteurs de l'ancienne zone de front de la Première Guerre mondiale, ou éventuellement des forestiers de cette même zone (cf. forêt de guerre) ou des membres de services d'urgences (pompiers...) qui auraient été en contact avec des munitions ou un environnement souillé par des munitions sont a priori les personnes les plus à risque. Mais toute personne présentant les symptômes caractéristiques d'une intoxication de ce type immédiatement après avoir manipulé des munitions anciennes ou avoir séjourné dans un lieu à risque doit être considérée comme probablement intoxiquée et faire l'objet de soins diligents avec le conseil de spécialistes (centre antipoison, toxicologue...).
La lewisite fait partie des nombreux toxiques suivis dans le cadre du risque terroriste. Conduite à tenir en cas d'exposition suspectéeEn cas de risque d'exposition, même douteux, l'intervention rapide d'un médecin spécialisé ou prenant les conseils de spécialiste est recommandée (SAMU, centre antipoison, toxicologue…). Dans un environnement à risque, les secours doivent eux-mêmes être protégés par des équipements de protection individuelle appropriés aux risques encourus. Une éventuelle contamination de l'environnement doit être recherchée et réduite. Des procédures recommandées sont prévues par la convention de 1993 pour tous les échantillons environnementaux. Une contamination inexpliquée par l'arsenic est l'un des signes qui peuvent alerter. ÉcotoxicitéL'écotoxicité générale du produit semble avoir été peu étudiée dans le passé, mais l'est depuis peu, en mer notamment, en mer Baltique autour de dépôts de munitions chimiques immergés. D'autre part, les dégâts observés chez l'animal de laboratoire exposé durant 2, 4 ou 6 minutes à de la vapeur de lewisite sont similaires à ceux observés chez l'homme. On peut donc penser que les fuites à partir de munitions perdues dans l'environnement posent des problèmes graves pour la faune. De plus, à la différence de l'ypérite, la lewisite contient (pour 1/3 de son poids) de l'arsenic non dégradable qui est aussi un inhibiteur de la croissance des plantes à partir d'une certaine dose et qui éradique toute forme de vie du sol au-delà d'un certain seuil (localement atteint sur certains sites très pollués par des armes chimiques). Rémanence : elle varie selon les conditions. Après une explosion d'obus chimique ou après une fuite dans l'environnement, on peut détecter la molécule mère dans l'air durant plusieurs heures, puis ses produits de dégradation et métabolites durant quelques jours (produits d'hydrolyse, de condensation sur les fonctions SH et d'oxydation) puis on la détecte encore quelques mois sur des adduits covalents sur cibles biologiques, dont sur les protéines et l'ADN durant quelques mois (7-8-9). Les matrices potentielles sont les tissus, sièges initiaux de l'agression (peau, voies respiratoires), le système sanguin (sang total, plasma, sérum), l'urine et salive, les plus faciles à collecter, ou parfois les organes de stockage (cheveux, foie, graisses) en post-mortem. Les impacts sur la fonge et la flore ont été peu étudiés, mais on peut supposer que ce gaz 7 fois plus lourd que l'air envahissait rapidement des terriers et était susceptible d'affecter la flore. Des témoignages de poilus ou de soldats allemands et des images d'archives font état sur la ligne de front d'arbres ayant perdu toutes leurs feuilles et d'animaux morts après le passage des nuages toxiques de gaz chlorés ou après les tirs d'obus chimiques. On a d'ailleurs inventé des masques à gaz pour chevaux et chiens dans les mois qui ont suivi le début de l'usage des armes chimiques dans les tranchées. Par chance et par hasard, l'essentiel de la ligne de front de 14-18 est située en zone calcaire et son caractère alcalin atténue les effets de la lewisite, de ses produits de dégradation et de manière générale des métaux lourds. Cinétique de la lewisite dans l'écosystèmeDans les milieux marins : tant qu'elle est dans un contenant étanche, ou dans l'obus chimique, la lewisite ne perd que peu de son pouvoir toxique. Immergée en mer comme cela a souvent été le cas, la lewisite reste liquide (alors que l'ypérite est pâteuse). Quand les bidons ou obus fuient, la lewisite est donc a priori plus facilement diffusée dans le milieu. Selon les sources disponibles, c'est un produit qui s'hydrolyse assez rapidement dans l'eau où elle perd donc celles de ses propriétés toxiques dues au chlore. Néanmoins, la lewisite contient une grande quantité d'arsenic (1/3 environ de son poids), or cet arsenic n'est pas biodégradable, et il est présent sous une forme très toxique (à la différence par exemple de l'arsenic utilisé comme agent durcisseur dans les balles de plomb des munitions conventionnelles) ; cet arsenic restera présent sous une forme très biodisponible, et pour longtemps dans l'environnement aquatique. Les organismes filtreurs en particulier, de même que le réseau trophique marin, peuvent rapidement le reconcentrer. Les scientifiques travaillant pour la commission HELCOM mesurent déjà une augmentation des taux d'arsenic dans l'eau, les sédiments ou les organismes marins en mer Baltique autour de dépôts de munitions immergées, par exemple près de l'île de Bornholm. Sur terre : plusieurs des « records du monde » de pollution de sols par l'arsenic ont été enregistrés sur des sites de fabrication ou de démantèlement (incinération des arsines), dont à Ypres et en France (par exemple sur le site dit « place à gaz » en forêt de Verdun[20] où on a relevé des taux d'arsenic (17 % du poids du sol) jusqu'à dix mille fois plus élevés que la moyenne des « zones rouges » qui sont des secteurs les plus touchés par le front de la Première Guerre mondiale). Démantèlement, destruction des munitions en contenantIl existe globalement trois catégories d'armes contenant de la lewisite :
La plupart des pays ont jeté une grande partie de leurs stocks en mer[22].
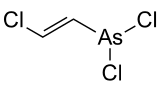
Réactions chimiques, synthèseLe composé est préparé à partir d'arsenic trichloré et d'acétylène :
Il s'agit en fait d'une réaction catalysée nécessitant la présence de mercure :
La lewisite, comme d'autres produits arséniés chlorés, s'hydrolyse dans l'eau en formant un acide qui est un poison, mais peu volatil.
Cette réaction est accélérée en milieu alcalin (ce qui était localement le cas dans les tranchées de la Première Guerre mondiale, quand elles étaient creusées dans la craie et humides). Dans ce cas, le produit de dégradation est l'arsénite de sodium ; c'est encore un poison, mais non volatil et moins biodisponible. Controverse sur les dépôts d'armes chimiques laissés par l'armée du Japon en ChineMi 2006, la Chine et le Japon ont finalement négocié un traitement avec l'aide du Japon des stocks importants de lewisite laissés dans le nord de la Chine après la Seconde Guerre mondiale. Des résidents chinois sont morts accidentellement depuis 30 ans à la suite d'un contact accidentel avec la lewisite abandonnée sur leur territoire[23]. Voir aussiArticles connexesLiens externes
Bibliographie
1989, vol. 110, p. 75-115 [41 page(s) (article)] Ed : Springer, Heidelberg, Allemagne (1987) Notes et références
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


![{\displaystyle \mathrm {AsCl_{3}+HC\equiv CH{\xrightarrow[{HCl}]{HgCl_{2}-Lsg}}Cl_{2}As-HC=CHCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4c6edf085438259093ab16d985aef624289332db)