|
Passivation La passivation ou passivité représente un état des métaux ou des alliages dans lequel leur vitesse de corrosion est notablement ralentie par la présence d'un film passif naturel ou artificiel, par rapport à ce qu'elle serait en l'absence de ce film. Dans la plupart des cas (aluminium, acier, acier inoxydable, titane…), ce film passif apparaît spontanément par oxydation, parce que l'oxyde formé sur la surface est insoluble et constitue un obstacle qui ralentit les processus ultérieurs. Dans un milieu aqueux, la formation de ce film est liée à un domaine de potentiel électrochimique ainsi qu'à un domaine de pH dans lesquels l'oxyde est stable. De ce fait, on s'attache à ce que le film passif se forme à l'air avant la mise en service de la pièce :
Immunité : on parle d’immunité lorsque le métal est stable en présence du milieu corrodant. Dépassivation, repassivation Il peut se produire une rupture de la couche passive : rayure, mise en extension de la surface (la couche d'oxyde n'est pas ductile), abrasion… on dit parfois que la surface devient active. La réaction avec l'oxygène du milieu peut permettre la reformation d'un film passif. Dans le cas où l'élément passivant est en solution solide dans l'alliage — cas par exemple du chrome dans les aciers inoxydables —, on a un appauvrissement local en élément passivant. Si la situation se renouvelle, le métal n'est plus protégé et se corrode en surface. La succession dépassivation-repassivation est un des mécanismes de la corrosion sous contrainte et de la fatigue-corrosion. Comportement électrochimique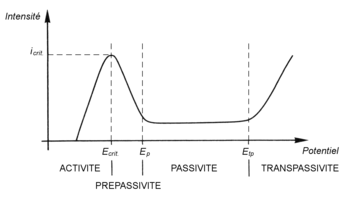 La figure ci-contre représente le courant de dissolution du métal ou alliage passivable en fonction du potentiel électrochimique. Dans le domaine actif du matériau métallique, celui-ci s'accroit lorsque le potentiel augmente, puis à partir d'un potentiel dit critique (noté Ecrit et appelé potentiel de flade), on observe une chute drastique du courant de dissolution, généralement de plusieurs ordres de grandeur. Ce phénomène manifeste l'apparition du film passif, généralement causée par la formation d'un oxyde protecteur non poreux. Ce film ralentit une des clés du processus de corrosion, soit le transport de matière jusqu'à l'interface métallique, soit le transport d'électrons nécessaire à l'oxydation parce que le film est peu conducteur. À partir du potentiel de passivité (Ep), on observe le « domaine de passivité », zone où le courant varie peu avec le potentiel. Ensuite, au-delà d'une certaine valeur appelée « potentiel de transpassivité » (Etp), le courant augmente à nouveau rapidement. Le film passif, devenu instable à ce potentiel, est dissous et sa protection disparaît. On a atteint le domaine « transpassif ». La présence du film passif est aussi liée à un domaine de stabilité en pH. Généralement, le film devient instable vers les milieux acides, en deçà d'un pH qui dépend du matériau, ainsi que vers les milieux très basiques. Les diagrammes thermodynamiques potentiel-pH du métal permettent de prévoir avec une approximation suffisante ces domaines de stabilité. On peut aussi obtenir la passivation de manière artificielle par le traitement avec un produit approprié qui permet d'obtenir une couche barrière (habituellement un produit acide pour les inox par exemple) d'un métal désoxydé préalablement avec un acide pour l'empêcher de se réoxyder rapidement. Pour désoxyder une pièce de métal, on procède à une dissolution de l'oxyde à l'aide d'une attaque avec un acide adapté. Il en résulte une ionisation H+ de la surface de cette pièce (pH < 7 : acide). Au contact de l'air, les ions H+ se combinent avec les ions OH- et favorisent donc une réoxydation de la pièce. On procède donc à un traitement, par exemple avec un produit alcalin (OH-), pour éliminer cette ionisation et donc empêcher cette recombinaison. Ce traitement est nommé passivation. Les différentes passivationsPassivation du zincLe zinc est trop sensible à la corrosion atmosphérique pour pouvoir rester longtemps à l’extérieur sans altération. Il est d’usage de protéger le zinc par conversion chimique au chrome. Par conversion chimique, une fine pellicule superficielle de 1 à 2 µm de zinc est dissoute en milieu acide oxydant et forme un sel de zinc protecteur. Le chrome est l’élément le plus efficace et forme l’ensemble des passivations chromiques de couleur variées : clair irisé, bleu, jaune irisé, vert ou noir. Le chrome hexavalent (génère les chromatations sur zinc), aujourd'hui banni pour l’industrie automobile et toutes pièces comportant un système électrique ou électronique, est remplacé principalement par le chrome trivalent (génère des passivations sur zinc)[1]. HistoireLe chrome est très dangereux dans sa forme oxydée au degré 6 : CrVI ou Cr6 mais sa variante trivalente ne l’est plus. La protection des employés au poste de travail imposait que le législateur prévienne les risques toxicologiques lors de la manipulation des pièces à la fois lors de la fabrication mais aussi en utilisation quotidienne. Les Directives européennes sur les véhicules hors d’usage (VHU ou Directive 2000/53[2]) et sur l’utilisation des substances dangereuses (RoHS ou Directive 2002/95[3]) ont banni l’utilisation du Chrome hexavalent dans les passivations de conversion au chrome. En ciblant les pièces électriques ou électroniques, la Directive 2002/95 a touché, de fait, beaucoup d’industries et rares sont les applications des chromatations où le CrVI est encore permis. Les passivations n’ont pas de bonnes propriétés de frottement et s’utilisent très souvent avec des finitions organo-minérales ou finitions renforcées. Les premières finitions renforcées sont apparues dans les normes de PSA (B154100 et suivantes) et de Renault (série des 01-71-002) dans les années 90. Elles concernaient particulièrement la visserie-boulonnerie pour laquelle ces propriétés lubrifiantes sont particulièrement recherchées pour le contrôle du coefficient de frottement. L’évolution des normes automobiles coïncide avec la recherche de qualité. Notamment les exigences de résistance à la corrosion sont passées en termes de tenue au brouillard salin NF A05 109 de 200h avant rouille rouge en 1985 à 400 h en 1992, puis 600 h en 2000 pour atteindre 720 h en 2002[4]. Cette évolution est comparable à tout ce qui s’est passé en Europe de l’Ouest dans la même période où pratiquement tous les constructeurs automobiles ont choisi la même politique de recherche de qualité. ProcédésLa chromatation au CrVI[5]La chromatation du zinc était très répandue et s’appliquait facilement après zinc électrolytique par formation d’une couche complexe épaisse jusqu’à 4 µm pour les couches noires sur zinc-fer. Le zinc immergé dans la solution acide chromatante est dissous en surface jusqu’à 2 µm et se redépose sous forme d’un sel insoluble complexe suivant les réactions suivantes :
3 Zn + 2 CrO42− + 10 H+
Cr2O72− + 8 H+ + 6 e− N.B. : Cette réduction n’est jamais complète et explique l’abandon du CrVI
 La chromatation forme une couche riche en eau et assez molle. Il s’agit d’un gel qui ne supporte pas les montées en température et perd ses capacités protectrices au-delà de 120 °C. La parade consiste à déposer des couches de finitions organo-minérales dont la silice garantit le maintien de l’hydratation et par là-même des propriétés anti-corrosion. L’oxydation du zinc a lieu en milieu acide en général en présence de nitrates oxydants : 2 Zn + 2 HNO3 + 4 H+ Suivi de la formation de sels de chrome : Zn2+ + x CrIII + y H2O La passivation composée d’hydroxydes se déshydrate facilement au séchage et devient très dure. Son épaisseur atteint 200 nm ou 400 nm pour les passivations renforcées avec de la silice. Les couleurs de ces couches de passivations plus fines que les chromatations sont plus claires et varient du clair irisé au jaune clair. La couleur noire est obtenue grâce à la présence d’oxydes de fer, de nickel ou de cobalt. Sa teinte est renforcée par une finition organo-minérale indispensable sur ce type de dépôt car la passivation noire ne garantit pas à elle seule une bonne résistance à la corrosion. La finition organo-minérale peut être remplacée par une finition supplémentaire purement minérale à base de phosphate de chrome aussi appelée post-dip. ApplicationsL’application des chromatations ou passivations se fait en général au trempé, intégré dans une ligne de zingage. Au trempé, les pièces subissent des traitements humides :
Marchés
SiliciumNickelAluminiumDans le cas de l'aluminium, le film passif apparaît spontanément par oxydation. L'oxyde formé (Al2O3) sur la surface est insoluble et constitue un obstacle qui ralentit le processus de corrosion. Si on enlève cet oxyde par formation d'amalgame (alliage de mercure) avec le mercure Hg, le métal n'est plus protégé et il sera rapidement oxydé même dans l'eau froide. Matériaux contenant du ferLe béton armé est alcalin, avec un pH voisin de 12. Le ciment assure une passivation naturelle des armatures du béton armé. La diminution du pH du béton par carbonatation entraîne progressivement la corrosion des fers, en laissant traverser l'oxygène. La profondeur de carbonatation est de l’ordre de 4 mm après 2 ans, 10 mm après 8 ans, 20 mm après 25 ans, pour un béton dosé 350 kg/m3. Les différents procédés de PassivationPassivation à l'acide citriqueL'utilisation de l'acide citrique (C6H8O7) dans la passivation émerge comme une solution efficace, écologiquement responsable et sécuritaire, offrant une alternative aux méthodes traditionnelles comme l'emploi de l'acide nitrique. L'acide citrique se distingue par son origine naturelle et sa biodégradabilité, marquant un point fort pour les industries en quête de solutions durables. Son adoption réduit la nécessité d'équipements de protection , diminuant les coûts et les risques pour les opérateurs. Contrairement à d'autres procédés, il n'engendre pas d'émissions de vapeurs toxiques, telles que les oxydes d'azote (N2O), contribuant ainsi à un environnement de travail plus sain et à une moindre empreinte écologique. L'intégration de l'acide citrique dans les procédures de passivation respectent les normes industrielles, incluant ASTM A-380 et ASTM A-967[8]. Passivation à l'acide nitriqueVoir aussiNotes et références
Bibliographie
Information related to Passivation |