|
Simmetria molecolare In chimica, la simmetria molecolare descrive la simmetria presente nelle molecole e la classificazione delle molecole in base alla loro stessa simmetria applicando la teoria dei gruppi. Oltre che trovare applicazione in strutturistica chimica, viene comunemente impiegata per prevedere proprietà chimiche come la chiralità o quelle derivanti dalla presenza di un momento di dipolo molecolare, e per prevedere le transizioni spettroscopiche permesse. Applicando gli stessi concetti di simmetria agli orbitali molecolari è possibile elaborare un approccio integrato con la trattazione quantomeccanica del legame chimico. Concetti di simmetria Elementi di simmetriaUn elemento di simmetria è un punto, una retta, o un piano che descrivono una data simmetria di una molecola. Esistono 4 elementi di simmetria:[1]
Operazioni di simmetriaUn'operazione di simmetria è un'azione che lascia immutata una molecola.[1] A un'operazione di simmetria è associato uno o più elementi di simmetria. Le principali sono:
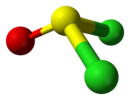
Soventemente le operazioni di simmetria sono indicate utilizzando simboli identici a quelli dei rispettivi elementi di simmetria. Gruppi puntualiSulla base degli elementi di simmetria posseduti è possibile ascrivere una molecola a un particolare gruppo puntuale; in chimica la notazione comunemente utilizzata consiste nel sistema Schoenflies. Ad esempio un composto quale CHBrClF, caratterizzato dalla sola identità, appartiene al gruppo puntuale C1. Il perossido di idrogeno, oltre all'identità, possiede anche un asse di rotazione binario e pertanto si colloca nel gruppo puntuale C2. La molecola dell'acqua, con un asse di rotazione binario e due piani speculari verticali, appartiene al gruppo C2v, mentre l'ammoniaca possiede un asse C3 e 3σv per cui si colloca nel gruppo C3v. Le molecole lineari come il monossido di carbonio o l'acido cloridrico appartengono invece al gruppo puntuale C∞v; aumentando gli elementi di simmetria si passa a gruppi quali D2h, D3h, D4h... fino a giungere al gruppo tetraedrico Td (del quale fa parte ad esempio il metano), a quello ottaedrico Oh (vi appartengono molecole quali l'esafluoruro di zolfo) e a quello icosaedrico Ih caratteristico del fullerene C60 e di una serie di composti del boro. In generale, si procede alla determinazione di un gruppo puntuale ricorrendo a un diagramma di flusso in cui il primo passo consiste nel determinare se una molecola è lineare oppure no. La seguente tabella contiene una lista dei gruppi puntuali con le molecole rappresentative. La descrizione della struttura comprende anche le forme comuni delle molecole basate sulla teoria VSEPR.
Tavole dei caratteriLe tavole dei caratteri sono utilizzate per elencare sinteticamente il risultato delle operazioni di simmetria e i relativi tipi di simmetria caratteristici di uno specifico gruppo puntuale. Sono molto utili dal punto di vista pratico, ad esempio per determinare in modo relativamente agevole quali orbitali possono combinarsi in un legame chimico, considerando che si combinano gli orbitali che presentano medesima simmetria. Per ricavare le tavole dei caratteri bisogna esprimere le operazioni di simmetria nella notazione matriciale. Dato un set base di partenza è possibile ottenere una cosiddetta matrice rappresentativa per ogni operazione di simmetria. Ad esempio partendo da un insieme di tre orbitali di valenza p (indicati come pA, pB e pC), nel gruppo puntuale C2v considerando un'operazione σv si ottiene l'insieme (pA, pC, pB). In termini matriciali ciò equivale alla moltiplicazione dove D(σv) è la matrice rappresentativa. Se la trasformazione di base permette che tale matrice sia fattorizzabile in una matrice a blocchi diagonale, allora si è in presenza di una rappresentazione riducibile che per successive fattorizzazioni fornisce infine una rappresentazione monodimensionale irriducibile. I caratteri sono ottenuti proprio da queste rappresentazioni irriducibili. Riassumendo quanto detto sopra, nel caso del gruppo puntuale C2v qui considerato si perviene alla seguente tavola dei caratteri:
La prima colonna indica i tipi di simmetria: le lettere A e B indicano rappresentazioni monodimensionali; quando la rotazione intorno l'asse principale ha il carattere +1 si utilizza la lettera A, mentre quando ha il carattere −1 si utilizza la lettera B. A1 indica la rappresentazione che possiede tutti caratteri con valore +1. Quando esistono rappresentazioni di ordine maggiore si utilizzano rispettivamente la lettera E nel caso di rappresentazioni bidimensionali e la lettera T per rappresentazioni tridimensionali. Da notare che gli orbitali che possiedono una data simmetria sono invece indicati con stesse lettere però in minuscolo. Le colonne successive elencano le operazioni di simmetria (riunite in classi) e i rispettivi caratteri delle rappresentazioni irriducibili: il carattere +1 indica la conservazione della simmetria, mentre il valore −1 indica l'antisimmetria. La colonna in cui compare h=4 indica nell'intestazione l'ordine del gruppo (il numero totale di operazioni di simmetria) e la base della rappresentazione irriducibile (orbitali px, py, pz o la rotazione R attorno a un asse cartesiano). L'ultima colonna indica le basi analoghe per le funzioni di secondo grado (gli orbitali d). Le tavole dei caratteri per ciascun gruppo puntuale sono raccolte in pubblicazioni scientifiche specialistiche. NoteBibliografia
Collegamenti esterni
Information related to Simmetria molecolare |