外見
黄色がかった銀白色
一般特性
名称 , 記号 , 番号
セシウム, Cs, 55
分類
アルカリ金属
族 , 周期 , ブロック
1 , 6 , s
原子量
132.9054519 (2)
電子配置
[Xe ] 6s1
電子殻
2, 8, 18, 18, 8, 1(画像 )
物理特性
相
固体
密度 (室温 付近)
1.93 g/cm3
融点 での液体密度
1.843 g/cm3
融点
301.59 K , 28.44 °C , 83.19 °F
沸点
944 K , 671 °C , 1240 °F
臨界点
1938 K , 9.4 MPa
融解熱
2.09 kJ/mol
蒸発熱
63.9 kJ/mol
熱容量
(25 °C ) 32.210 J/(mol·K)
蒸気圧
圧力 (Pa)
1
10
100
1 k
10 k
100 k
温度 (K)
418
469
534
623
750
940
原子特性
酸化数
1 (強塩基性酸化物 )
電気陰性度
0.79(ポーリングの値)
イオン化エネルギー
第1: 375.7 kJ/mol
第2: 2234.3 kJ/mol
第3: 3400 kJ/mol
原子半径
265 pm
共有結合半径
244±11 pm
ファンデルワールス半径
343 pm
その他
結晶構造
体心立方構造
磁性
常磁性 [ 1]
電気抵抗率
(20 °C ) 205Ω⋅m
熱伝導率
(300 K) 35.9 W/(m⋅K)
熱膨張率
(25 °C ) 97 μm/(m⋅K)
ヤング率
1.7 GPa
体積弾性率
1.6 GPa
モース硬度
0.2
ブリネル硬度
0.14 MPa
CAS登録番号
7440-46-2
主な同位体
詳細はセシウムの同位体 を参照
セシウム (新ラテン語 : caesium [ 3] 英 : cesium [ˈsiːziəm] 原子番号 55の元素 。元素記号 は、「灰青色の」を意味するラテン語の c aes ius カエシウスより Cs 。軟らかく黄色がかった銀色をしたアルカリ金属 である。融点は28.44 °C で、常温付近で液体状態をとる5種類 の金属元素 のうちの一つである[ 注 1]
セシウムの化学的・物理的性質は同じくアルカリ金属のルビジウム やカリウム と似ていて、水と−116 °C で反応するほど反応性に富み、自然発火 する。安定同位体を持つ元素の中で、最小の電気陰性度 を持つ。セシウムの安定同位体 はセシウム133 のみである。セシウム資源となる代表的な鉱物 はポルックス石 である[ 5]
セシウムは、ウラン の代表的な核分裂 生成物である[ 6] 放射性同位体 のセシウム137 は比較的多量に発生し、核兵器 の使用や原発事故時の放射性降下物 に含まれるため放射能汚染 の原因となる。
2人のドイツ人化学者、ロベルト・ブンゼン とグスタフ・キルヒホフ は、1860年 に当時の新技術である炎光分光分析 (英語版 ) 鉱泉 からセシウムを発見した。初めての応用先は真空管 や光電素子 のゲッター (英語版 ) 1967年 、セシウム133の発光スペクトル の比振動数が国際単位系 の秒 の定義に選ばれた。それ以来、セシウムは原子時計 として広く使われている。
1990年代以降のセシウムの最大の応用先は、ギ酸セシウム を使った掘穿泥水 (英語版 ) 水文学 などに応用されている。
1860年 、ドイツの化学者グスタフ・キルヒホフ とロベルト・ヴィルヘルム・ブンゼン が、発光スペクトル の輝線が青色を呈することからラテン語 の caesius(青色)にちなんで命名した[ 注 2] [ 7] [ 8]
セシュウム 常磐井守泰「種々の汚染対象物への布状セシュウム吸着材の適用経験 」『日本原子力学会 年会・大会予稿集』2013年春の年会、日本原子力学会、2013年、629頁、doi :10.11561/aesj.2013s.0.629.0 、NAID 130004569233 。 ( , 中尾行憲「講89. 胎盤のセシュウム137沈着量について 」『日本産科婦人科學會雜誌』第19巻第8号、日本産科婦人科学会、1967年、987-988頁、NAID 110002195198 、NDLJP :10665848 。 セシューム [ 9]
アルゴン中に保存されている高純度のセシウム133 セシウムは非常に軟らかく(全ての元素の中で最小のモース硬度 を持つ)、延性に富む銀白色の金属である。少しでも酸素 が存在すると金色を帯びてくる[ 10] [ 11]
融点 は28.4 °C で、常温付近で液体である五つの元素のうちの一つである。金属の中でセシウムは水銀 に次いで融点が低い[ 注 3] [ 13] 沸点 は641 °C で金属としてはかなり低く、これも金属の中で水銀に次いで低い[ 14] [ 15]
化合物が燃焼するときに青から紫色の炎を伴うが、これはセシウムの炎色反応 によるものである[ 16] [ 17] スペクトル線 および、697.3 nm、672.3 nmの赤色を示す一対のスペクトル線によるものであり、この特徴的な青色の輝線はセシウムの名前の由来ともなっている[ 18] 電子 のスピンに二つの方向があるためであり、他のアルカリ金属元素でも同様の双子線が見られる[ 18]
冷水に少量の金属セシウムを加えると爆発する。以下の外部リンク も参照。 金属セシウムは非常に反応性に富み、自然発火 しやすい。また、低温でも水と爆発的に反応し、他のアルカリ金属よりも反応性が高い[ 10] [ 13] 消防法 で危険物 に指定されている。保存や運送は、乾燥状態にした鉱物油 などの炭化水素を満たした容器に入れて行う。同様の理由で、取り扱いはアルゴン や窒素 などの不活性ガス の下で行わなければならない。真空で密閉されたホウケイ酸ガラス のアンプル で保存できる。100 g以上のセシウムは、ステンレス製の容器に密閉されて輸送される[ 10]
セシウムの化学的性質は他のアルカリ金属、特に周期表 で直上にあるルビジウム と似ており[ 19] 錯体 を形成する。ほかの(放射性でない)アルカリ金属に比べて、原子量が大きく電気的に陽性なので、性質にわずかな違いが生ずる[ 20] 陽性 なものである[ 注 4] [ 13] 軟らかい 。そのイオン半径の大きさに起因して、他のアルカリ金属元素より多い配位数を取る傾向がある[ 20] 137 Cs+ を大量の非放射性のカリウムイオン中から分離するために用いられるなど、核廃棄物の改善において研究が重ねられている[ 22] 2 を形成し、Cs11 O3 のような一部の亜酸化物においてもCs-Csの共有結合が見られる[ 23]
セシウムの結晶構造。格子定数 a = 614 pm 他のアルカリ金属と同様、金属セシウムは標準状態 において体心立方格子 構造を取る立方晶 であり(α-Cs)、格子定数 は a = 614 pm、空間群 は Im 3 m である。41 kbar の圧力下で面心立方格子 構造へと相転移 し(β-Cs)、その際の格子定数は a = 598 pm となる[ 24]
セシウムのイオン半径 は非常に大きいため、イオン半径の小さい他のアルカリ金属元素よりも多い配位数を取る。この傾向は、他のアルカリ金属の塩化物が6配位の塩化ナトリウム型構造を取るのとは対照的に、セシウムの塩化物が8配位の塩化セシウム型構造を取ることに象徴される[ 20] 体心立方格子 から成っている。臭化セシウム (CsBr) やヨウ化セシウム (CsI)、その他多くのセシウムを含まない化合物もこの塩化セシウム型構造を取る。塩化セシウム型構造は、Cs+ のイオン半径が174 pm、Cl- のイオン半径が181 pmと大きさが近いために形成される[ 25]
CsCl 中の Cs と Cl の立方配位の球棒モデル ほとんどすべてセシウム化合物は、セシウムを Cs+ カチオン として持っており、これがさまざまなアニオン とイオン結合 している。例外として、アルカリド である Cs- アニオンを含むものがある[ 26]
Cs+ の塩は、アニオンが有色でない限りほとんど無色である。吸湿性 であるものが多いが、他の軽いアルカリ金属よりはその度合いは弱い。セシウムの酢酸塩 、炭酸塩 、酸化物 、硝酸塩 、硫酸塩 は水に可溶である。複塩 の多くはあまり水に溶けないので、硫酸アルミニウムセシウムは鉱石からセシウムを精製するのに利用される。アンチモン 、ビスマス 、カドミウム 、銅 、鉄 、鉛 との複塩(たとえば CsSbCl4 )も難溶性である[ 10]
水酸化セシウム は吸湿性の強塩基 性物質である[ 19] ケイ素 などの半導体 の表面をすみやかにエッチング する作用を持つ[ 27] + と OH- の相互作用が小さいことから、CsOH は最も強い塩基であると考えられていた[ 16] N -ブチルリチウムナトリウムアミド をはじめ、CsOH より塩基性が強い化合物は数多く見いだされるに至った[ 19]
ヨウ化セシウム (CsI) は、エックス線蛍光倍増管・ガンマ線検出用単結晶に用いられる。
Cs11 O3 の球棒モデル 。頂点の紫の球はセシウムを表し、三つの赤い球は酸素を表す アルカリ金属元素は酸素との二元化合物を多く形成するが[ 28] 超酸化物 の CsO2 が主に生成する[ 29] 2 - ) のような不安定な陰イオンが、イオン半径の大きなセシウムの格子エネルギー効果によって安定化されるためである[ 28]
Cs
+
O
2
⟶
CsO
2
{\displaystyle {\ce {Cs + O2 -> CsO2}}}
「通常の」セシウム酸化物 である Cs2 O は黄色からオレンジ色をした六方晶であり[ 30] [ 28] [ 31] °C で蒸発し、400 °C で金属セシウムと過酸化物 Cs2 O2 に分解する[ 32] オゾン化物 CsO3 [ 33] [ 34] [ 35] 7 O、Cs4 O、Cs11 O3 、Cs3 O(暗緑色[ 36] 3 O2 [ 37] 7 O2 が含まれる[ 38] [ 39] 硫化物 、セレン化物 およびテルル化物 も存在する[ 10]
セシウムは他のアルカリ金属や金 と合金 をつくり、水銀とアマルガム をつくる。650 °C 以下では、コバルト 、鉄 、モリブデン 、白金 、タンタル 、タングステン とも合金をつくる。アンチモン 、ガリウム 、インジウム 、トリウム とは、明瞭な金属間化合物 をつくり、これらは感光性 (英語版 ) [ 10] モル濃度 で41%のセシウム、47%のカリウム、12%のナトリウムからなる合金は、すべての合金の中で最低の融点 (-78 ℃) を持つ[ 13] [ 40] 2 は紫色の金属光沢をもつ黒色物質で、CsHg は同様に金属光沢を持つ金色の物質である[ 41]
セシウムは112から151までの幅の質量数(すなわち、原子核 中の核子 数)を持つ39種の既知の同位体を有する。これらの内のいくつかは、古い星の中での遅い中性子捕獲 プロセス(s過程 )[ 42] 超新星爆発 時(r過程 )に軽い元素から合成される[ 43] スピン角運動量 を持っており、この同位体を利用してNMR測定 による構造解析が行われる(磁場強度11.74 Tのとき共鳴周波数65.6 MHz)[ 44]
137 Cs の崩壊放射性同位体であるセシウム135は230万年という非常に長い半減期を有しており、セシウム137およびセシウム134はそれぞれ30年および2年という半減期である。セシウム137はベータ崩壊 によって短命なバリウム137mに壊変し、その後非放射性のバリウムとなる。セシウム134は直接バリウム134に壊変する。質量数129、131、132および136の同位体は、半減期が1日から2週間の間であり、他の大部分の同位体の半減期は2–3秒から数分の1秒である。少なくとも21種類の準安定な核異性体 が存在する。3時間未満の半減期を持つセシウム134m以外は非常に不安定で、2–3分以下の半減期で崩壊する[ 45] [ 46]
同位体元素のセシウム135は、ウランの核反応によって生成する長寿命核分裂生成物 の一つである[ 47] [ 48] [ 49]
セシウム137はバリウム137mへとベータ崩壊するため、ガンマ線 の強い発生源である[ 50] [ 51] チェルノブイリ原子力発電所事故 の周囲の地域で発生している放射能の発生源の大部分を占めている[ 52] [ 53]
ほとんど全てのセシウムは、ベータ崩壊系列 によって生成した中性子/陽子比の高いヨウ素とキセノンのベータ崩壊を通じて生成する[ 54] [ 55] 1945年 頃から始まった核実験によってセシウム137は空気中に放出され、放射性降下物 の構成物質として地表に降り注いだ[ 10]
人工的に作られる(ウラン の核分裂により生ずる)セシウム137 は、半減期 30.07年の放射性同位体である。
U
92
235
+
1
n
⟶
92
236
U
⟶
55
137
Cs
+
37
96
Rb
+
3
1
n
{\displaystyle {\ce {^{235}_{92}U\ +^{1}{\mathit {n}}->_{92}^{236}U->_{55}^{137}Cs\ +_{37}^{96}Rb\ +3^{1}{\mathit {n}}}}}
体内に入ると血液の流れに乗って腸や肝臓にベータ線とガンマ線を放射し、カリウム と置き換わって筋肉に蓄積したのち、腎臓を経て体外に排出される。セシウム137は、体内に取り込まれてから体外に排出されるまでの100日から200日にわたってベータ線とガンマ線を放射し体内被曝の原因となるため、危険性が指摘されている。セシウム137に汚染された空気や飲食物を摂取することで、体内に取り込まれる。なお、ヨウ素剤 を服用してもセシウム137の体内被曝を防ぐことはできない。セシウム137は医療用の放射線源に使われているが、1987年 には、ブラジル のゴイアニア で廃病院からセシウム137が盗難に遭った上、光るセシウム137の塊に魔力を感じた住民が体に塗ったり飲んだりしたことで250人が被曝 、4人が死亡する大規模な被曝事件が発生している(ゴイアニア被曝事故 )。
植物(農作物)での移行係数 (TF) は、農作物中濃度 (Bq) ÷ 土壌中濃度 (Bq) で表される。カリウム (K) と似た挙動を示すとされているが、動物と植物での挙動は異なる。なお、観測されている「濃縮」は環境中と細胞内での電解質濃度の差に由来するものであり、Kに対して際だってCsを濃縮する様な生物種は観測されていない。代謝に伴って常に生体内のアルカリ金属、アルカリ土類金属は細胞を出入りしており、重金属の場合のような蓄積に起因する「濃縮」は生じないとされる。
植物の種類および核種により移行係数は異なる。イネ 、ジャガイモ 、キャベツ を試料とした研究によれば、安定同位体のセシウム133と比較すると放射性のセシウム137は植物に移行しやすい。イネでは移行したセシウム元素の大部分が非可食部であるわら などに含まれ、キャベツでは非可食部である外縁部のセシウムおよびストロンチウム の濃度が高くなることが報告されている[ 56]
降下した放射性物質が土壌の表層に多く存在するため、表層の物質を主な栄養源とする菌類の種では植物と比較すると、特異的に高い濃縮度を示すものがあり、屋外で人工栽培されるシイタケ やマイタケ でも濃度が高くなる傾向があることが報告されている[ 57]
主に軟組織に広く取り込まれて分布し、生物濃縮により魚食性の高い魚種(カツオ 、マグロ 、タラ 、スズキ など)での高い濃縮度を示すデータが得られているが、底生生物を主な餌とする魚種(カレイ、ハタハタ、甲殻類 、頭足類 、貝類)では比較的濃縮度は低い。また大型の魚種ほど、濃縮度が高くなることが示唆されている。若い魚や高水温域に生息する魚ほど、代謝が良く排出量が多くなるため蓄積量は少ないと考えられている。体内に取り込まれる経路は、餌がほとんどであるが、鰓を通じて直接取り込まれる経路もあり、それぞれの経路の比率についてのデータは不足している[ 58] [ 59]
現代でのセシウムの主要な用途のうちの一つは、石油採掘産業におけるギ酸セシウムを使った掘穿泥水 (英語版 ) [ 60] - Cs+ ) は水酸化セシウムとギ酸 との反応によって作られ、1990年代 半ばに油井 を掘削する際の仕上流体として開発された。掘穿泥水は油井を掘る際に用いられる溶液であり、これを掘削ドリルから噴出させて地表へと循環させることで地層を掘り進める際に発生する土砂を地表へと運びだし、常に掘削ドリルから噴出させることで、刃先の冷却と潤滑を行なって掘削効率を向上させる。同時に、採掘抗がこの溶液で満たされることによって適度な内圧が保たれ、採掘抗の崩落 を防ぐとともに地下水 の混入を防ぐなど、油井の掘削に欠かせない様々な機能が要求される[ 10] [ 61] [ 10]
ギ酸セシウム溶液の密度は最高 2.3 g/cm3 と高い[ 62] ギ酸カリウム もしくはギ酸ナトリウム と混ぜ合わせることで、密度を 1 g/cm3 まで低下させることができる。他の多くの高密度な溶液に用いられる物質と違い、ギ酸セシウムは相対的に環境負荷 が小さい[ 62] 浮遊物質 の使用量を低減でき、また、多くのセシウム化合物がそうであるようにギ酸セシウムの反応性は比較的穏やかであるなど、環境的に大きな利点を有する。さらに生分解性であり、使用後にそのまま埋め立てることもできる。ギ酸セシウムはコストが高い点(1バレル およそ4,000ドル、2001年[ 63] リサイクル の可能性も検討されている。また、臭化亜鉛 (ZnBr2 ) のような腐食性の高密度塩溶液と比較して、アルカリ金属のギ酸塩は扱いが安全であり、その腐食性の低さに起因して設備などの生産編成や採掘抗の金属素材に損傷を与えない。それらの要素はまた、使用後の洗浄と処分のコストがより少なく済むことも意味している[ 10]
原子時計の集合体(アメリカ海軍天文台 ) セシウム133はセシウム原子時計 の基準点に使われる。その時間は、セシウム133の超微細準位における電磁気的な遷移の観測によって決定される。最初の精密なセシウム原子時計は、1955年にイギリス国立物理学研究所 においてルイ・エッセン (英語版 ) [ 64] 14 分の2から3ほどの精度があり、これは1日に2ナノ秒もしくは140万年に1秒の時間のずれに一致する。最新のものでは1015 分の1と、より改善された精度を有し、これは恐竜の絶滅した6500万年前以降の期間でおよそ2秒のずれしか生じない事を意味しており[ 10] [ 65]
セシウム時計は、携帯電話における送信の計時や、インターネットにおける情報の流れの監視にも用いられる[ 66]
セシウム蒸気を用いた熱電子発電は、熱エネルギーを電気エネルギーに変換する低出力の装置である。真空管のコンバーターを正極と陰極の間に置くことで、陰極の近くで蓄積される空間電荷を無効にすることができ、その際に電流の流れが強化される[ 67]
光エネルギーを電流に変換する光電特性 の意味でもまた、セシウムは重要である。金属間化合物である K2 CsRb のようなセシウムベースの陰極は電子の放出のための立上がり電圧が低いため、セシウムは光電セルに用いられる[ 68] [ 69] [ 70] ゲルマニウム やルビジウム、セレン 、ケイ素 、テルル および他の元素をセシウムの代替とすることができる[ 10]
ヨウ化セシウム (CsI)、臭化セシウム (CsBr)、フッ化セシウム (CsF) の結晶は、ガンマ線およびエックス線 の検出に適したものとして、鉱物の調査や素粒子物理学 の研究において広範囲に用いられ、シンチレーション検出器 におけるシンチレーターに使われる。セシウムは重い元素であるため阻止能 が向上でき、優れた検出感度を発揮させることができる。セシウムの化合物はまた、より早い応答能 (CsF) や、より低い吸湿性 (CsI) にも寄与する。
セシウムの蒸気は、多くの一般的な磁気センサ に用いられる[ 71] 分光測色計 の内部標準にも用いられる[ 72] [ 73] レーザー 、蛍光灯 におけるグローランプのガス、セシウム蒸気整流器 などが含まれる[ 10]
塩化物 (CsCl) や硫酸塩 (Cs2 SO4 )、トリフルオロ酢酸 塩 (Cs(OCOCF3 )) 溶液の高比重を利用して、一般的に分子生物学 の分野において密度勾配超遠心法に用いられる[ 74] ウイルス や細胞 内の細胞小器官 および断片、そして生体サンプルからの核酸 などの分離に利用される[ 75]
塩化セシウム セシウムの化学的用途は比較的少ない[ 76] アクリル酸 やアントラキノン 、メタノール 、無水フタル酸 、スチレン 、メタクリル酸メチル のモノマー および様々なオレフィン といった化合物の生産において、いくつかの金属イオン触媒の効果を強化するために用いられる。セシウムはまた、接触法による硫酸 の生産において、触媒として用いられる五酸化バナジウム に添加される[ 77]
フッ化セシウムは、有機化学 において塩基 としてまれに用いられる[ 19] [ 78] 環化反応 やエステル化 反応、重合反応 に用いられる。
放射性同位体 のセシウム137 はコバルト60 と同様に強いガンマ線 を発するので、産業用のガンマ線照射用の線源として用いられる重要な放射性同位体 である。その利点として、およそ30年という半減期、核燃料サイクル由来のセシウム137を利用できること、そして最終的に安定なバリウム137となることが挙げられる。水溶性が高いため食物および医薬品への照射には適さないという欠点もある[ 79] 農業 や癌治療 、また、食品や下水汚泥、医療器具の殺菌などに使われている[ 10] [ 80] [ 81] [ 82] [ 83] すきまゲージ を含む、様々な産業用測定器に用いられている[ 84] [ 85]
セシウム137は、水文学 においてトリチウム と同様に用いられる。セシウム137は核兵器 の爆発および原子力発電所 からの放出物によって生み出される。1945年頃に開始され、1980年代まで続けられた核実験によってセシウム137は大気圏 に放出され、すぐに水に吸収された。その期間における経年変化は、土壌や堆積物層の情報と関係付けることができる。セシウム134、およびより狭い範囲においてセシウム135もまた、原子力産業によるセシウムの放出量の算定に、水文学において用いられている。それらの同位体はセシウム133やセシウム137よりは存在量が多くないが、完全に人工的なものであることが利点である[ 86]
セシウムまたは水銀の用途として開発された静電荷電粒子推進器の概略図 惑星間での、あるいは惑星外への超長期間の航行を目的とした宇宙船 のために設計された初期のイオンエンジン の推進剤として、セシウムおよび水銀が使われていた。電圧を印加したタングステン 電極と接触させ、外殻の電子を奪うという方法でイオン化することにより、推進剤として用いられた。しかし、宇宙船の構成要素としてセシウムには腐食性についての懸念があったため、キセノンのような不活性ガスを推進剤として利用する方向へと開発は進んだ。キセノンは、地上でのテストにおいて取り扱いが簡単で、宇宙船に対する干渉がより少ない可能性がある[ 10] ディープ・スペース1号 にはキセノンが使われた[ 87] [ 88] [ 89]
硝酸セシウム は近赤外スペクトルにおいて強い光を発するため[ 90] [ 91] 照明弾 においてケイ素を燃焼させるための酸化剤・炎色発光剤として用いられる[ 92] SR-71 軍用機における排気ガス のレーダー反射断面積 を減らすために用いられる[ 93] 電気伝導度 を減少させるので、光ファイバー や暗視装置 の安定性と耐久性を向上させるため、炭酸塩としてガラス に添加される。フッ化セシウムやフッ化セシウムアルミニウムは、マグネシウム を含有したアルミニウム 合金をろう付け するために配合された融剤 に用いられる[ 10]
MHD発電 システムは研究されているが、広く受け入れられることに失敗している[ 94] ランキンサイクル ターボ発電機の作動流体としての候補にも挙がっている[ 95] てんかん の治療にも用いられた[ 10]
セシウムを分光器で発見したグスタフ・キルヒホフ(左)とロベルト・ブンゼン(中央) セシウムの発光スペクトル。この青色の輝線からセシウムと名付けられた。 1860年 、ドイツの化学者グスタフ・キルヒホフ とロベルト・ヴィルヘルム・ブンゼン がバート・デュルクハイム (en:Bad Dürkheim )の鉱泉の水から発見した[ 注 5] [ 7] [ 8] [ 13]
セシウムの純粋な試料を得るためには、44,000 Lの鉱水を蒸発させて240 kgの濃縮塩溶液を作らなければならなかった。分離過程は以下のようなものである。まずアルカリ土類金属 は硫酸塩 もしくはシュウ酸塩 として沈殿分離され、溶液中にはアルカリ金属類が残された。次に硝酸塩 へと変換してエタノール で抽出することで、ナトリウムを含まない混合物が得られた。この混合液から、リチウム は炭酸アンモニウム によって沈殿させて分離された。カリウム、ルビジウムおよびセシウムはヘキサクロリド白金(IV)酸 によって不溶性塩を形成させた。これらのヘキサクロリド白金酸塩は、温水に対してわずかに溶解性の差異を示す。したがって、溶解性の低いセシウムおよびルビジウムのヘキサクロリド白金(IV)酸塩 ((Cs,Rb)2 PtCl6 ) が分別晶出によってわずかに得られた。水素 によるヘキサクロリド白金酸塩の還元の後、セシウムとルビジウムは炭酸塩のアルコールに対する溶解度の違いによって分離された。この過程によって、44,000 Lの鉱水から、9.2 gの塩化ルビジウム と7.3 gの塩化セシウムが得られた[ 7]
キルヒホフとブンゼンの二人は、このようにして得られた塩化セシウムを用いてこの新しい元素の原子量が123.35であると推定した(現在一般に認められている値は132.9である)[ 7] 電気分解 によって単体 のセシウムを作ろうとしたが、金属の代わりに、肉眼での観察においても顕微鏡での観察においても金属物質であるというわずかな痕跡も示さない、青色の均一な物質が得られた。その結果、彼らはこれを亜塩化物 (Cs2 Cl) であるとしたが、実際には恐らくコロイド 状の金属と塩化セシウムの混合物であった[ 96] アノード 電極を用いた塩化物溶液の電気分解では、水の存在下ですぐさま分解するセシウムアマルガムが生じた[ 7] アウグスト・ケクレ とブンゼンのもとで博士号のための研究をしていたドイツの化学者カール・セッテルベルグによって単離された[ 8] [ 97]
歴史的に最も重要なセシウムの用途は、主に化学および電気の分野における研究開発向けであった。セシウムの極めて少ない用途としては、1920年代まではラジオの真空管 に用いられていた。それには、真空管製造後の管内の余分な酸素を除去するゲッターとしての役目と、熱せられたカソードの電気伝導度 を向上させるためのコーティング剤としての役目の二つの機能があった。セシウムは1950年代までは高性能な工業用金属として認められていなかった[ 98] 光電子増倍管 、赤外分光光度計の光学部品、いくつかの有機反応における触媒 、シンチレーション検出器 用の結晶、MHD発電 などが含まれる[ 10]
1967年以降、国際単位系 は時間の秒 の単位の基準にセシウムの性質を用いた基準を採用している。国際単位系は、セシウム133原子の二つの基底状態 における超微細準位間の移行と一致する、放射の9,192,631,770サイクルの長さを1秒と定義した[ 65] 国際度量衡総会 において、1秒の長さは「外部から疎外されない基底状態におけるセシウム133の超微細準位の移行によって発生もしくは吸収されるマイクロ波光線の9,192,631,770サイクルの時間」と定義された。
セシウムの放射性同位体であるセシウム137は、原子爆弾 が投下された広島市 と長崎市 の両方で記録が残っている「黒い雨 」(原子爆弾投下後に地上に「降下する」放射性降下物 の一形態)に含まれていたと考えられていて、原子爆弾が投下後の広島における降雨範囲を特定するために土壌中のセシウム137の測定結果が利用されている。
また、文部科学省 において放射性セシウム分析法が1963年 に制定され、1976年 に改訂されている[ 99]
セシウム鉱石のポルサイト セシウムは地殻 中に平均およそ3 ppmの濃度で存在していると見積もられており、比較的珍しい元素である[ 100] アンチモン やカドミウム 、スズ 、タングステン のような元素よりは豊富であり、水銀 や銀 よりは2桁多く存在するが、セシウムと化学的に密接に関連するルビジウム はさらに30倍ほど多い[ 10]
その大きなイオン半径のため、セシウムは「不適合元素 」の一つである[ 101] マグマ が結晶化する過程で、セシウムは液相で濃縮され最後に結晶化する。したがってセシウムは、これらの濃縮過程によって形成されるペグマタイト鉱物 に最も大きく堆積 する。ルビジウムはカリウムと置換する性質があるが、セシウムはルビジウムほどすぐには置換しないため、アルカリ蒸発岩 のカリ岩塩 (シルビン、KCl)やカーナライト (KMgCl3 •6H2 O) には0.002%程度のセシウムのみしか含まれない。したがって、セシウムは鉱物 ではほとんど見られない。パーセント単位のセシウムは緑柱石 (Be3 Al2 (SiO3 )6 ) およびアボガドロ石 ((K,Cs)BF4 ) で見られることがある。また、最高15重量パーセントの Cs2 O を含むものとして密接に関連した鉱物ペツォッタイト (Cs(Be2 Li)Al2 Si6 O18 ) が、最高8.4重量%の Cs2 O を含むものとして希少鉱物のロンドン石 (英語版 ) 4 Be4 (B,Be)12 O28 ) が、セシウム濃度がより少なく広範囲にわたるものとしてローディズ石 (英語版 ) [ 10] ポルサイト (Cs(AlSi2 O6 )) である。これらは、世界中において数か所しかないベグマタイト地帯でのみ見つかり、より商業的に重要なリチウム鉱石 であるリシア雲母 およびペタライト と関連している。ペグマタイトの内部では、粒度が大きく、鉱物成分が強く分離していることで、採鉱のための良質な鉱物が形成されている[ 102]
世界で最も豊富なセシウム源の一つは、カナダ のマニトバ州 のベルニク湖にあるタンコ鉱山 である。その鉱床には350,000トン のポルサイト鉱石が埋蔵されていると見積られており、これは世界の埋蔵量の2/3を占めているといわれている[ 102] [ 103] [ 103] [ 104] ジンバブエ のビキタ (英語版 ) ナミビア のエロンゴ州 でも採掘されている[ 103] [ 10]
ポルサイト鉱石の採掘は選択的な過程であり、大部分の金属鉱山の操業と比較して小規模である。鉱石は砕かれたあと手作業で選鉱 されるが、通常は濃縮工程を経ずそのまま磨り潰される。セシウムは主に酸による分解、アルカリによる分解、直接還元の三つの方法でポルサイトから抽出される[ 10] [ 105]
酸分解において、ポルサイト中のケイ酸塩 は塩酸 (HCl) や硫酸 (H2 SO4 )、臭化水素酸 (HBr)、フッ化水素酸 (HF) のような強酸によって溶解される。塩酸によって可溶性塩化物の混合物が作られ、不溶性の塩化セシウムの複塩はアンチモンとの複塩 (Cs4 SbCl7 ) やヨウ素との複塩 (Cs2 ICl)、セリウム との複塩 (Cs2 (CeCl6 ) として沈殿する。これらを分離したのち、沈殿物として得られた純粋な複塩は分解され、水分を蒸発させることで純粋な塩化セシウムが得られる。硫酸を用いた方法では、セシウムミョウバン (CsAl(SO4 )2 •12H2 O) として直接不溶性の複塩が得られる。セシウムミョウバン中の硫酸アルミニウム は、ミョウバンを炭素と共に焼成することで不溶性の酸化アルミニウム に変化させ、可溶性の 硫酸セシウム (Cs2 SO4 ) を水で抽出して水溶液とすることで分離される[ 10]
炭酸カルシウム および塩化カルシウム とともにポルサイトを焼成させることで不溶性のケイ酸カルシウムと可溶性の塩化セシウムが得られる。これを水もしくは希アンモニア水 (NH4 OH) で溶出させることで塩化セシウム溶液が得られる。この溶液を蒸発させることで塩化セシウムを得ることができ、反応させることでセシウムミョウバンもしくは炭酸セシウムを得ることもできる。商業的に採算の合う方法ではないが、真空中でカリウムまたはナトリウムもしくはカルシウムを用いて鉱石の直接還元させることで、直接金属セシウムを生産することができる[ 10]
塩類として採掘されたセシウムは、大部分が石油掘削などに利用するためギ酸セシウム (HCOOCs) に直接変換される。発展途上な市場へと供給するため、キャボット社 (Cabot Corporation ) は1997年にカナダのマニトバ州ベルニク湖近郊のタンコ鉱山で、年間12,000バレル のギ酸セシウム溶液を生産する能力を有する工場を建設した[ 106] 硝酸セシウム である[ 107]
あるいは、鉱石から精製したセシウム化合物から金属セシウムが製造されることもある。塩化セシウムおよびその他のセシウムハロゲン化物はカルシウムもしくはバリウムによって700 °C から800 °C で還元され、次いで蒸留することによって金属セシウムが得られる。
2
CsCl
+
Ca
⟶
2
Cs
↑
+
CaCl
2
{\displaystyle {\ce {2CsCl + Ca -> 2Cs (^) + CaCl2}}}
同様に、アルミン酸塩や炭酸塩、水酸化物も、マグネシウム によって還元することができる[ 10] 電気分解 によって単離することもできる。特に純粋でガスを含まないセシウムは、水溶性の硫酸セシウムとアジ化バリウムから作られるアジ化セシウム (CsN3 ) を390 °C で熱分解することによって得られる[ 105] ジルコニウム と反応させることによって気体を副生させずに純粋なセシウム金属が生成する[ 107]
Cs
2
Cr
2
O
7
+
2
Zr
⟶
2
Cs
+
2
ZrO
2
+
Cr
2
O
3
{\displaystyle {\ce {Cs2Cr2O7 + 2 Zr -> 2 Cs + 2 ZrO2 + Cr2O3}}}
2009年 の純度99.8%の金属セシウムの価格は、メタルベースで1 g当たり10ドル (1オンス当たり280ドル)であるが、化合物はかなり安価である[ 103]
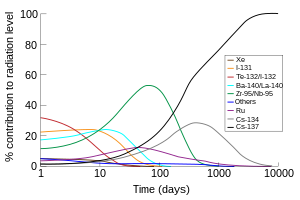
チェルノブイリ原発事故後における、空気中の総放射線量の時間変化と各々の同位体元素の割合。事故のおよそ200日後には、セシウム137は放射線源の最大の発生源となっている[ 108] セシウム化合物は普通の人にとっては滅多に触れることがない物質だが、大部分のセシウム化合物はカリウムとセシウムの化学的類似性に由来するわずかな毒性がある。大量のセシウム化合物への曝露は刺激と痙攣を引き起こすが、それほどの量の自然中におけるセシウム源とは通常遭遇せず、環境化学においてセシウムは主要な汚染物質ではない[ 109] マウス における塩化セシウムの半数致死量 (LD50 ) の値は体重1 kgあたり2.3 gであり、これは塩化カリウム および塩化ナトリウム の値にほぼ等しい[ 110]
金属セシウムはもっとも反応性の高い元素のひとつであり、水との接触に際して非常に高い爆発性を有する。金属セシウムと水との反応によって生成する水素ガスは、その反応と共に放出される熱エネルギーによって加熱され、発火と激しい爆発を引き起こす。
2
Cs
+
2
H
2
O
⟶
2
CsOH
+
H
2
↑
{\displaystyle {\ce {2 Cs + 2 H2O -> 2 CsOH + H2 (^)}}}
そのような反応は他のアルカリ金属においても起こるが、セシウムにおいては、この爆発が冷水によっても十分引き金となり得るほどに強力である[ 10] ガラス は速やかに腐食される[ 111]
放射性物質の漏洩に由来して、同位体元素のセシウム134およびセシウム137は少量が生物圏に存在しているが、場所によって異なる放射能負荷の指標となる。放射性セシウムは放射性ヨウ素や放射性ストロンチウムなどの他の多くの核分裂生成物と比較すると人体に蓄積しにくい。他のアルカリ金属と同様に、放射性セシウムは尿 と汗 によって比較的早く排出される。一方で、放射性セシウムはカリウムとともに、果物 や野菜 などの植物の細胞に蓄積する傾向がある[ 112] [ 113] [ 114] キノコ が子実体 に蓄積することも示されている[ 115] チェルノブイリ原子力発電所事故 後に強く懸念されていた[ 116] [ 117] 国際原子力機関 などは、セシウム137のような放射性物質は放射能兵器 もしくは「汚い爆弾 」に用いることが可能であると警告した[ 118] チェルノブイリ原子力発電所事故 で放出された放射性セシウムによる健康リスク調査でも、危険性の程度に関して様々な主張がある[ 119] [ 120] [ 121]
^ 他の4種類の金属元素の融点は、ルビジウム が39.31 °C 、フランシウム が推定で27 °C 、水銀 が−38.83 °C 、ガリウム が29.76 °C である。臭素 も常温で液体である(融点-7.2 °C )が、ハロゲン は金属ではない[ 4]
^ ブンゼンはアウルス・ゲッリウス の『アッティカの夜』2巻26章に書かれたニギディウス・フィグルス による言葉 “Nostris autem veteribus caesia dicts est quae Graecis, ut Nigidus ait, de colore coeli quasi coelia.” より引用した。
^ おそらく放射性元素であるフランシウム のほうが低い融点を持つだろうが、放射性崩壊が速すぎて純粋なフランシウムの試料が得られないのでそれを実証できない[ 12]
^ フランシウム はさらに陽性であるだろうが、放射性崩壊が速すぎて純粋なフランシウムの試料が得られないので、電気陰性度を測定できない。フランシウムの第一イオン化エネルギー の測定値から示唆されることは、相対論効果 が反応性を下げ、周期律 から予想される値より電気陰性度を上げていることである[ 21] ^ ブンゼンはアウルス・ゲッリウス の『アッティカの夜』2巻26章に書かれたニギディウス・フィグルス による言葉 “Nostris autem veteribus caesia dicts est quae Graecis, ut Nigidus ait, de colore coeli quasi coelia.” より引用した。
^ “Magnetic susceptibility of the elements and inorganic compounds” (PDF), Handbook of Chemistry and Physics (81st ed.), CRC press, オリジナル の2004-03-24時点におけるアーカイブ。, https://web.archive.org/web/20040324080747/http://www-d0.fnal.gov/hardware/cal/lvps_info/engineering/elementmagn.pd 2010年9月26日 閲覧。 ^ “"NIST Radionuclide Half-Life Measurements" ”. 2011年3月13日 閲覧。 ^ http://wordinfo.info/unit/3087/ip:32 ^ “WebElements Periodic Table of the Elements ”. University of Sheffield. 2010年12月1日 閲覧。 ^ 36セシウム(Cs) 独立行政法人石油天然ガス・金属鉱物資源機構 ^ “環境省_原子炉内の生成物 ”. www.env.go.jp . 2023年11月20日 閲覧。 ^ a b c d e Kirchhoff, G. ; Bunsen, R. (1861), “Chemische Analyse durch Spectralbeobachtungen”, Annalen der Physik und Chemie 189 (7): 337–381, doi :10.1002/andp.18611890702
^ a b c Weeks, Mary Elvira (1932), “The discovery of the elements. XIII. Some spectroscopic discoveries”, Journal of Chemical Education 9 (8): 1413–1434, doi :10.1021/ed009p1413
^ 飯沼武「東日本大震災と福島原発事故(2011.03.11)の1年目にあたって 」『日本乳癌検診学会誌』第21巻第2号、日本乳癌検診学会、2012年、202-202頁、doi :10.3804/jjabcs.21.202 、ISSN 0918-0729 、NAID 130004713770 。 石黒政一, 増永将二, 島田寿一, 奥野武, 赤尾文雄「セシュームハライド : Tlの蛍光 : イオン結晶光物性 : 光学的性質II 」『日本物理学会春季分科会講演予稿集』第1965.2巻、日本物理学会、1965年、297頁、doi :10.11316/jpsgaiyob.1965.2.0_297 、NAID 110002027165 。 ^ a b c d e f g h i j k l m n o p q r s t u v w x y z Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. (2004) (PDF), Mineral Commodity Profile: Cesium , http://pubs.usgs.gov/of/2004/1432/2004-1432.pdf 2009年12月27日 閲覧。
^ Heiserman, David L. (1992), Exploring Chemical Elements and their Compounds , McGraw-Hill, pp. 201–203, ISBN 0-8306-3015-5 ^ “Francium ”. Periodic.lanl.gov. 2010年2月23日 閲覧。 ^ a b c d e Kaner, Richard (2003年). “C&EN: It's Elemental: The Periodic Table – Cesium ”. American Chemical Society. 2010年2月25日 閲覧。
^ “Chemical Data – Cesium – Cs ”. Royal Society of Chemistry. 2010年9月27日 閲覧。 ^ 千谷 (1959) 76頁。^ a b Lynch, Charles T. (1974), CRC Handbook of Materials Science ISBN 978-0-8493-2321-8 , https://books.google.co.jp/books?id=QdU-lRMjOsgC&pg=PA13&lpg=PA13&dq=cesium+compounds+burn+blue&redir_esc=y&hl=ja#v=onepage&q&f=false 2010年9月27日 閲覧。
^ 千谷 (1959) 82頁。^ a b 千谷 (1959) 83頁。
^ a b c d Greenwood, N.N.; Earnshaw, A. (1984), Chemistry of the Elements , Oxford, UK: Pergamon Press, ISBN 0-08-022057-6
^ a b c Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985), “Vergleichende Übersicht über die Gruppe der Alkalimetalle” (German), Lehrbuch der Anorganischen Chemie (91–100 ed.), Walter de Gruyter, pp. 953–955, ISBN 3-11-007511-3
^ Andreev, S. V.; Letokhov, V. S.; Mishin, V. I. (1987), “Laser resonance photoionization spectroscopy of Rydberg levels in Fr”, Physical Review Letters 59 : 1274–76, doi :10.1103/PhysRevLett.59.1274 , PMID 10035190 ^ Moyer, Bruce A.; Birdwell, Joseph F.; Bonnesen, Peter V.; Delmau, Laetitia H. (2005), Use of Macrocycles in Nuclear-Waste Cleanup: A Realworld Application of a Calixcrown in Cesium Separation Technology , pp. 383–405, doi :10.1007/1-4020-3687-6_24 ^ コットン、ウィルキンソン (1987) 249頁。^ K. Schubert (1974), “Ein Modell für die Kristallstrukturen der chemischen Elemente”, Acta Crystallographica Section B 30 : pp.193–204, doi :10.1107/S0567740874002469 ^ Wells, A.F. (1984), Structural Inorganic Chemistry (5 ed.), Oxford Science Publications, ISBN 0-19-855370-6 ^ Dye, J. L. (1979), “Compounds of Alkali Metal Anions”, Angewandte Chemie International Edition 18 (8): 587–598, doi :10.1002/anie.197905871 ^ Köhler, Michael J. (1999), Etching in microsystem technology ISBN 3-527-29561-5 , https://books.google.com/?id=F-8SltAKSF8C&pg=PA90&lpg=PA90&dq=caesium+hydroxide+etch+quartz&q=cesium ^ a b c コットン、ウィルキンソン (1987) 255頁。
^ Cotton, F. Albert; Wilkinson, G. (1962), Advanced Inorganic Chemistry , John Wiley & Sons, Inc., p. 318, ISBN 0-471-84997-9 ^ Lide, David R., ed. (2006), CRC Handbook of Chemistry and Physics (87th ed.), Boca Raton, FL: CRC Press, pp. 451,514, ISBN 0-8493-0487-3 ^ Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. (1956), “The Crystal Structure of Cesium Monoxide”, Journal of Physical Chemistry 60 : 338–344, doi :10.1021/j150537a022 ^ “Information Bridge: DOE Scientific and Technical Information ” (PDF). Office of Scientific and Technical Information — U.S. Department of Energy (2009年11月23日). 2011年5月11日 閲覧。 ^ Vol'nov, I. I.; Matveev, V. V. (1963), “Synthesis of cesium ozonide through cesium superoxide”, Bulletin of the Academy of Sciences, USSR Division of Chemical Science 12 : 1040–1043, doi :10.1007/BF00845494 ^ Tokareva, S. A. (1971), “Alkali and Alkaline Earth Metal Ozonides”, Russian Chemical Reviews 40 : 165–174, doi :10.1070/RC1971v040n02ABEH001903 ^ Simon, A. (1997), “Group 1 and 2 Suboxides and Subnitrides — Metals with Atomic Size Holes and Tunnels”, Coordination Chemistry Reviews 163 : 253–270, doi :10.1016/S0010-8545(97)00013-1 ^ Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. (1956), “The Crystal Structure of Tricesium Monoxide”, Journal of Physical Chemistry 60 : 345–347, doi :10.1021/j150537a023 ^ Okamoto, H. (2009), “Cs-O (Cesium-Oxygen)”, Journal of Phase Equilibria and Diffusion 31 : 86, doi :10.1007/s11669-009-9636-5 ^ Band, A.; Albu-Yaron, A.; Livneh, T.; Cohen, H.; Feldman, Y.; Shimon, L.; Popovitz-Biro, R.; Lyahovitskaya, V. et al. (2004), “Characterization of Oxides of Cesium”, The Journal of Physical Chemistry B 108 : 12360–12367, doi :10.1021/jp036432o ^ Brauer, G. (1947), “Untersuchungen ber das System Csium-Sauerstoff”, Zeitschrift fr anorganische Chemie 255 : 101, doi :10.1002/zaac.19472550110 ^ Taova, T. M. et al. (2003年6月22日). “Density of melts of alkali metals and their Na-K-Cs and Na-K-Rb ternary systems ” (PDF). Fifteenth symposium on thermophysical properties, Boulder, CO, USA . 2006年10月9日時点のオリジナル よりアーカイブ。2010年9月26日 閲覧。 ^ Deiseroth, H. J. (1997), “Alkali metal amalgams, a group of unusual alloys”, Progress in Solid State Chemistry 25 (1–2): 73–123, doi :10.1016/S0079-6786(97)81004-7 ^ Busso, M.; Gallino, R.; Wasserburg, G. J. (1999), “Nucleosynthesis in Asymptotic Giant Branch Stars: Relevance for Galactic Enrichment and Solar System Formation” (PDF), Annula Review of Astronomy and Astrophysics 37 : 239–309, Bibcode : 1999ARA&A..37..239B , doi :10.1146/annurev.astro.37.1.239 , http://authors.library.caltech.edu/1194/1/BUSaraa99.pdf 2011年5月11日 閲覧。 ^ Arnett, David (1996), Supernovae and Nucleosynthesis: An Investigation of the History of Matter, from the Big Bang to the Present , Princeton University Press, p. 527, ISBN 0-691-01147-8 ^ Davis, Jeffery T.; Tirumala, Sampath K.; Marlow, Allison L. (1997). “A Self-Assembled Ionophore with Remarkable Cs+ Selectivity”. Journal of the American Chemical Society 119 : 5271–5272. doi :10.1021/ja970248x . ^ Brown, F.; Hall, G.R.; Walter, A.J. (1955), “The half-life of Cs137”, Journal of Inorganic and Nuclear Chemistry 1 : 241–247, doi :10.1016/0022-1902(55)80027-9 ^ Sonzogni, Alejandro. “Interactive Chart of Nuclides ”. National Nuclear Data Center: Brookhaven National Laboratory. 2011年5月11日 閲覧。 ^ Ohki, Shigeo; Takaki, Naoyuki (14–16 October 2002). Transmutation of Cesium-135 with Fast Reactors (PDF) . Seventh Information Exchange Meeting on Actinide and Fission Product Partitioning and Transmutation. Jeju, Korea. 2011年5月11日閲覧 。 ^ "20 Xenon: A Fission Product Poison". CANDU Fundamentals (PDF) (Report). CANDU Owners Group Inc. 2011年7月23日時点のオリジナル (PDF) よりアーカイブ。2011年5月11日閲覧 。 ^ Taylor, V. F.; Evans, R. D.; Cornett, R. J. (2008), “Preliminary evaluation of 135Cs/137Cs as a forensic tool for identifying source of radioactive contamination”, Journal of Environmental Radioactivity 99 (1): 109–118, doi :10.1016/j.jenvrad.2007.07.006 , PMID 17869392 ^ “Cesium | Radiation Protection ”. U.S. Environmental Protection Agency (2006年6月28日). 2011年3月15日時点のオリジナル よりアーカイブ。2011年5月11日 閲覧。 ^ Zerriffi, Hisham (24 May 2000). IEER Report: Transmutation – Nuclear Alchemy Gamble (Report). Institute for Energy and Environmental Research. 2011年5月11日閲覧 。 ^ Chernobyl's Legacy: Health, Environmental and Socia-Economic Impacts and Recommendations to the Governments of Belarus, Russian Federation and Ukraine (PDF) (Report). International Atomic Energy Agency. 2010年2月15日時点のオリジナル (PDF) よりアーカイブ。2011年5月11日閲覧 。^ Kase, Takeshi; Konashi, Kenji; Takahashi, Hiroshi; Hirao, Yasuo (1993), “Transmutation of Cesium-137 Using Proton Accelerator”, Journal of Nuclear Science and Technology 30 (9): 911–918, doi :10.3327/jnst.30.911 ^ Knief, Ronald Allen (1992), “Fission Fragments” , Nuclear engineering: theory and technology of commercial nuclear power , Taylor & Francis, p. 42, ISBN 978-1-56032-088-3 , https://books.google.co.jp/books?id=EpuaUEQaeoUC&pg=PA43&redir_esc=y&hl=ja 2011年5月11日 閲覧。 ^ 石渡, 名澄; 永井, 斉, “730. NSRRのパルス中性子照射によるUO2 ペレットからのXe-137とI-137の放出” , 日本原子力学会誌 23 (11): 843–850, https://doi.org/10.3327/jaesj.23.843 2022年11月7日 閲覧。 ^ 塚田 祥文, 環境中における放射性および安定同位体の移行と動態に関する研究 , https://hdl.handle.net/10097/16107 2011年5月30日 閲覧。 ^ “-栽培キノコ及び培地中における放射性セシウム濃度-” , RADIOISOTOPES (埼玉県衛生研究所、埼玉県農林総合研究センター、埼玉県保健医療部) Vol.57 (No.12): pp.753-757, (2008), https://doi.org/10.3769/radioisotopes.57.753 2011年5月30日 閲覧。 ^ 笠松 不二男, 海産生物と放射能 ―特に海産魚中の137 Cs濃度に影響を与える要因について 海洋生物環境研究所 , https://doi.org/10.3769/radioisotopes.48.266 2011年5月30日 閲覧。 ^ Katsura Hidemitsu, Accumulation of a Specific Nuclide by Feminam Okamejei kenojei spp. , http://www.asianjournalofchemistry.co.in/user/journal/viewarticle.aspx?ArticleID=25_14_121 2014年11月6日 閲覧。 ^ “NATIONAL INDUSTRIAL CHEMICALS NOTIFICATION AND ASSESSMENT SCHEME ” (pdf). Cabot Corporation. pp. p. 7 (17 October, 2001). 2011年5月4日 閲覧。 ^ 『知ってますか「石油の話」』化学工業日報社、1990年、40-41頁。ISBN 4873260701 。 ^ a b Downs, J. D.; Blaszczynski, M.; Turner, J.; Harris, M. (2006年2月). Drilling and Completing Difficult HP/HT Wells With the Aid of Cesium Formate Brines-A Performance Review doi :10.2118/99068-MS . 2007年10月12日時点のオリジナル よりアーカイブ。
^ Flatern, Rick (2001), “Keeping cool in the HPHT environment”, Offshore Engineer (February): 33–37 ^ Essen, L.; Parry, J.V.L. (1955), “An Atomic Standard of Frequency and Time Interval: A Cesium Resonator”, Nature 176 : 280, doi :10.1038/176280a0 ^ a b “Cesium Atoms at Work ”. Time Service Department—U.S. Naval Observatory—Department of the Navy. 2011年5月11日 閲覧。
^ Reel, Monte (2003年7月22日). “Where timing truly is everything” . Washington Post : p. B1. https://www.washingtonpost.com/ac2/wp-dyn/A25431-2003Jul21 2011年5月11日 閲覧。 ^ Rasor, Ned S.; Warner, Charles (September 1964), “Correlation of Emission Processes for Adsorbed Alkali Films on Metal Surfaces”, Journal of Applied Physics 35 (9): 2589–2600, doi :10.1063/1.1713806 ^ “Cesium Supplier & Technical Information ”. American Elements. 2011年5月11日 閲覧。 ^ Smedley, John; Rao, Triveni; Wang, Erdong; Crabb, Donald G.; Prok, Yelena; Poelker, Matt; Liuti, Simonetta; Day, Donal B. et al. (2009), “K 2 CsSb Cathode Development”, American Institute of Physics Conference Proceedings 1149 : 1062–1066, doi :10.1063/1.3215593 ^ Görlich, P. (1936), “Über zusammengesetzte, durchsichtige Photokathoden”, Zeitschrift für Physik 101 : 335–342, doi :10.1007/BF01342330 ^ Groeger, S.; Pazgalev, A. S.; Weis, A. (2005), “Comparison of discharge lamp and laser pumped cesium magnetometers”, Applied Physics B 80 : 645–654, doi :10.1007/s00340-005-1773-x ^ Haven, Mary C.; Tetrault, Gregory A.; Schenken, Jerald R. (1994), “Internal Standards” , Laboratory instrumentation , New York: John Wiley and Sons, p. 108, ISBN 978-0-471-28572-4 , https://books.google.co.jp/books?id=z9SzvsSCHv4C&pg=PA108&redir_esc=y&hl=ja 2011年5月11日 閲覧。 ^ McGee, James D. (1969), “Photo-electronic image devices: proceedings of the fourth symposium held at Imperial College, London, September 16–20, 1968” , 9780120145287 (Academic Press) 1 : p. 391, ISBN 978-0-12-014528-7 , https://books.google.co.jp/books?id=1o1WECNJkscC&pg=PA391&lpg=391&redir_esc=y&hl=ja 2011年5月11日 閲覧。 ^ Manfred Bick, Horst Prinz, "Cesium and Cesium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi :10.1002/14356007.a06 153 .
^ Desai, Mohamed A., ed. (2000), “Gradient Materials” , Downstream processing methods , Totowa, N.J.: Humana Press, pp. 61–62, ISBN 978-0-89603-564-5 , https://books.google.co.jp/books?id=1kn89nI2gUsC&pg=PA61&redir_esc=y&hl=ja 2011年5月11日 閲覧。 ^ Burt, R. O. (1993), “Cesium and cesium compounds”, Kirk-Othmer encyclopedia of chemical technology , 5 (4th ed.), New York: John Wiley & Sons, p. 759, ISBN 978-0-471-15158-6 ^ “硫酸辞典 ”. 硫酸協会. 2011年5月4日 閲覧。 ^ Gregory K. Friestad, Bruce P. Branchaud, Walter Navarrini, Maurizio Sansotera "Cesium Fluoride" in Encyclopedia of Reagents for Organic Synthesis 2007, John Wiley & Sons. doi :10.1002/047084289X.rc050.pub2
^ Okumura, Takeshi (2003年10月21日). “The material flow of radioactive cesium-137 in the U.S. 2000 ” (PDF). United States Environmental Protection Agency. 2011年5月11日 閲覧。 ^ Jensen, N. L. (1985), Cesium, in Mineral facts and problems , Bulletin 675 , U.S. Bureau of Mines, pp. 133–138 ^ “IsoRay's Cesium-131 Medical Isotope Used In Milestone Procedure Treating Eye Cancers At Tufts-New England Medical Center ”. Medicalnewstoday.com (2007年12月17日). 2011年5月11日 閲覧。 ^ Bentel, Gunilla Carleson (1996), “Cesium-137 Machines” , Radiation therapy planning , McGraw-Hill Professional, p. 22, ISBN 978-0-07-005115-7 , https://books.google.co.jp/books?id=bk0go_-FO5QC&pg=PA22&redir_esc=y&hl=ja 2011年5月11日 閲覧。 ^ National Research Council (U.S.). Committee on Radiation Source Use and Replacement (2008), Radiation source use and replacement: abbreviated version ISBN 978-0-309-11014-3 , https://books.google.co.jp/books?id=3cT2REdXJ98C&redir_esc=y&hl=ja 2011年5月11日 閲覧。 ^ Loxton, R., Pope, P., ed. (1995), “Level and density measurement using non-contact nuclear gauges” , Instrumentation : A Reader , London: Chapman & Hall, pp. 82–85, ISBN 978-0-412-53400-3 , https://books.google.co.jp/books?id=RwsoQbHYjvwC&pg=PA82&redir_esc=y&hl=ja 2011年5月11日 閲覧。 ^ Timur, A.; Toksoz, M. N. (1985), “Downhole Geophysical Logging”, Annual Review of Earth and Planetary Sciences 13 : 315, doi :10.1146/annurev.ea.13.050185.001531 ^ Kendall, Carol, Isotope Tracers Project – Resources on Isotopes – Cesium , http://wwwrcamnl.wr.usgs.gov/isoig/period/cs_iig.html 2011年5月11日 閲覧。 ^ Marcucci, M. G.; Polk, J. E. (2000), “NSTAR Xenon Ion Thruster on Deep Space 1: Ground and flight tests (invited)”, Review of Scientific Instruments 71 : 1389–1400, doi :10.1063/1.1150468 ^ Sovey, James S.; Rawlin, Vincent K.; Patterson, Michael J (PDF), A Synopsis of Ion Propulsion Development Projects in the United States: SERT I to Deep Space I オリジナル の2009-06-29時点におけるアーカイブ。, https://web.archive.org/web/20090629225625/http://gltrs.grc.nasa.gov/reports/1999/TM-1999-209439.pdf 2011年5月11日 閲覧。 ^ In-FEEP Thruster Ion Beam Neutralization with Thermionic and Field Emission Cathodes (PDF) . 27th International Electric Propulsion Conference. Pasadena, California. 2001年10月. pp. 1–15. 2011年5月11日閲覧 。^ Charrier, E.; Charsley, E.L.; Laye, P.G.; Markham, H.M.; Berger, B.; Griffiths, T.T. (2006), “Determination of the temperature and enthalpy of the solid–solid phase transition of cesium nitrate by differential scanning calorimetry”, Thermochimica Acta 445 : 36–39, doi :10.1016/j.tca.2006.04.002 ^ “LUU-19 Flare ”. Federation of American Scientists (2000年4月23日). 2011年5月11日 閲覧。 ^ “Infrared illumination compositions and articles containing the same ”. United States Patent 6230628 . Freepatentsonline.com. 2011年5月11日 閲覧。 ^ Crickmore, Paul F. (2000), Lockheed SR-71: the secret missions exposed , Osprey, p. 47, ISBN 978-1-84176-098-8 ^ National Research Council (U.S.) (2001), Energy research at DOE—Was it worth it? ISBN 978-0-309-07448-3 , http://books.nap.edu/openbook.php?isbn=0309074487&page=52 2011年5月11日 閲覧。 ^ Roskill Information Services (1984), Economics of Cesium and Rubidium (Reports on Metals & Minerals) , London, United Kingdom: Roskill Information Services, p. 51, ISBN 978-0-86214-250-6 ^ Zsigmondy, Richard (2007), Colloids and the Ultra Microscope ISBN 978-1-4067-5938-9 , https://books.google.co.jp/books?id=Ac2mGhqjgUkC&pg=PAPA69&redir_esc=y&hl=ja#v=onepage&q&f=false 2011年5月11日 閲覧。 ^ Setterberg, Carl (1882), “Ueber die Darstellung von Rubidium- und Cäsiumverbindungen und über die Gewinnung der Metalle selbst”, Justus Liebig's Annalen der Chemie 211 : 100–116, doi :10.1002/jlac.18822110105 ^ Strod, A.J. (1957), “Cesium—A new industrial metal”, American Ceramic Bulletin 36 (6): 212–213 ^ “No.3 放射性セシウム分析法 ”. 文部科学省 (1976年). 2015年4月4日 閲覧。 ^ Turekian, K.K.; Wedepohl, K. H. (1961), “Distribution of the elements in some major units of the Earth’s crust”, Geological Society of America Bulletin 72 (2): 175–192, doi :10.1130/0016-7606(1961)72[175:DOTEIS]2.0.CO;2 ^ Rowland, Simon (1998年7月4日). “Cesium as a Raw Material: Occurrence and Uses ”. Artemis Society International. 2011年5月11日 閲覧。 ^ a b Černý, Petr; Simpson, F. M. (1978), “The Tanco Pegmatite at Bernic Lake, Manitoba: X. Pollucite” (PDF), Canadian Mineralogist 16 : 325–333, https://rruff.geo.arizona.edu/doclib/cm/vol38/CM38_877.pdf 2011年5月11日 閲覧。
^ a b c d Polyak, Désirée E.. “Cesium ” (PDF). U.S. Geological Survey. 2011年5月11日 閲覧。
^ Norton, J. J. (1973), “Lithium, cesium, and rubidium—The rare alkali metals” , in Brobst, D. A., and Pratt, W. P., United States mineral resources , Paper 820 , U.S. Geological Survey Professional, pp. 365–378, http://pubs.er.usgs.gov/usgspubs/pp/pp820 2011年5月11日 閲覧。 ^ a b Burt, R. O. (1993), “Cesium and cesium compounds”, Kirk-Othmer encyclopedia of chemical technology , 5 (4th ed.), New York: John Wiley & Sons, Inc., pp. 749–764, ISBN 978-0-471-48494-3
^ Benton, William; Turner, Jim (2000), “Cesium formate fluid succeeds in North Sea HPHT field trials” (PDF), Drilling Contractor (May/June): 38–41, http://www.iadc.org/dcpi/dc-mayjun00/m-cabot.pdf 2011年5月11日 閲覧。 ^ a b transl. and rev. by Eagleson, Mary (1994), Concise encyclopedia chemistry ISBN 978-3-11-011451-5 , https://books.google.co.jp/books?id=Owuv-c9L_IMC&pg=PA198&redir_esc=y&hl=ja 2011年5月11日 閲覧。
^ Data from the OECD report and The radiochemical Manual (2nd ed.) B.J. Wilson (1966).
^ Pinsky, Carl; Bose, Ranjan; Taylor, J. R.; McKee, Jasper; Lapointe, Claude; Birchall, James (1981), “Cesium in mammals: Acute toxicity, organ changes and tissue accumulation”, Journal of Environmental Science and Health, Part A 16 : 549– 567, doi :10.1080/10934528109375003 ^ Johnson, Garland T.; Lewis, Trent R.; Wagner, D. Wagner (1975), “Acute toxicity of cesium and rubidium compounds”, Toxicology and Applied Pharmacology 32 (2): 239–245, doi :10.1016/0041-008X(75)90216-1 , PMID 1154391 ^ “Chemical Data – Cesium – Cs ”. Royal Society of Chemistry. 2011年5月11日 閲覧。 ^ Nishita, H.; Dixon, D.; Larson, K. H. (1962), “Accumulation of Cs and K and growth of bean plants in nutrient solution and soils”, Plant and Soil 17 : 221–242, doi :10.1007/BF01376226 ^ Avery, S. (1996), “Fate of cesium in the environment: Distribution between the abiotic and biotic components of aquatic and terrestrial ecosystems”, Journal of Environmental Radioactivity 30 : 139–171, doi :10.1016/0265-931X(96)89276-9 ^ Salbu, Brit; Østby, Georg; Garmo, Torstein H.; Hove, Knut (1992), “Availability of cesium isotopes in vegetation estimated from incubation and extraction experiments”, Analyst 117 (3): 487–491, doi :10.1039/AN9921700487 , PMID 1580386 ^ M Vinichuk, A F S Taylor, K Rosén, K J Johanson. Accumulation of potassium, rubidium and cesium ((133)Cs and (137)Cs) in various fractions of soil and fungi in a Swedish forest. Science of the total envrironment 03: 2010 DOI: 10.1016/j.scitotenv.2010.02.024
^ Smith, Jim T.; Beresford, Nicholas A., Chernobyl: Catastrophe and Consequences , Berlin: Springer, ISBN 3-540-23866-2 ^ Eremeev, V. N.; Chudinovskikh, T. V.; Batrakov, G. F.; Ivanova, T. M. (1991), “Radioactive isotopes of cesium in the waters and near-water atmospheric layer of the Black Sea”, Physical Oceanography 2 (1): 57–64, doi :10.1007/BF02197418 ^ Charbonneau, Louis (2003-03-12), “IAEA director warns of “dirty bomb” risk” , Washington Post (Reuters): p. A15, https://www.washingtonpost.com/ac2/wp-dyn/A12629-2003Mar11 2011年5月11日 閲覧。 ^ ユーリー・バンダジェフスキー著・久保田護訳『放射性セシウムが人体に与える 医学的生物学的影響:チェルノブイリ原発事故・被曝の病理データ 』合同出版・2011
^ チェルノブイリ事故調査結果を基に長崎大の山下俊一教授が明言「放射性セシウム汚染で疾患は増えない」 - 日経メディカル^ 今の放射線は本当に危険レベルか、ズバリ解説しよう - 日経ビジネス
F.A. コットン, G. ウィルキンソン『コットン・ウィルキンソン無機化学(上)』中原 勝儼(原書第4版)、培風館、1987年。ISBN 4-563-04192-0 。 千谷利三『新版 無機化学(上巻)』産業図書、1959年。