|
Glutationa
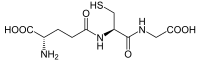
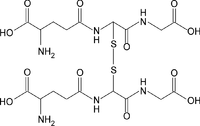 Glutationa, glutationo ou glutatião (γ-glutamilcisteinilglicina) é um tripeptídeo linear, com uma ligação 'Y-amida incomum, constituído por três aminoácidos: ácido glutâmico, cisteína e glicina, sendo o grupo tiol da cisteína o local ativo responsável pelas suas propriedades bioquímicas. É um antioxidante hidrossolúvel que está profusamente distribuída em tecidos animais, vegetais e em microrganismos, existe, na maioria das células, em concentrações compreendidas entre 1 e 8 mM, estando, geralmente, na sua maior quantidade no fígado. É o tiol mais prevalente e o mais abundante peptídeo de baixo peso molecular. Ao longo dos processos evolutivos foi adaptada para realizar uma gama diversa de funções, participando de vários processos metabólicos[3]. A Glutationa pode ser encontrada na forma reduzida (GSH) ou oxidada (GSSG, forma dimerizada da GSH). A razão GSH/GSSG é normalmente utilizada para estimar o estado redox dos sistemas biológicos, sendo extremamente importante. Em situações normais a GSSG representa apenas uma pequena fracção da glutationa total (menos de 10%). DescobertaFoi descrito pela primeira vez, em 1888 por Rey-Pailhade, como “philothion”, designando simplesmente algo que continha enxofre, posteriormente cristalizado por diversos investigadores, onde se verificou a presença relevante deste elemento, sendo assim designado de glutationa (L-gama-glutamil-L-cisteinilglicina)[4]. FunçãoA glutationa está omnipresente na célula, onde:
A mitocôndria e o núcleo têm a sua própria reserva de GSH, de importância crucial na proteção destas estruturas contra a ação das espécies reativas de oxigênio. Síntese e Catabolismo (degradação)A glutationa é sintetizada no fígado em dois passos, catalisados pela γ-glutamil-cisteina-sintetase (GCS) e pela glutationa-sintetase, usando o glutamato e a cisteína como substratos, formando o dipeptídeo γ-GluCys, o qual se combina com a glicina numa reação catalisada pela glutationa sintetase (GS) para a geração de GSH. A adenosina trifosfato (ATP) é co-substrato para ambas as enzimas. O nível intracelular de GSH é regulado por feedback, sendo a atividade da GCS inibida pelo seu produto final[10]. A GSH é distribuída, através da circulação sanguínea, para todos os tecidos. A degradação da GSH e GSSG ocorre ao nível extracelular e, especialmente, ao nível renal, numa reação catalisada pela γ-glutamiltranspeptidase (GGT) e pela cisteinil-glicina-dipeptidase[11]. As etapas da degradação são: (1) Catabolismo extenso internamente nos espaços apicais, bem como no interior de compartimentos sinusoidais de algumas espécies; (2) Recaptação celular de alguns produtos de degradação; (3) Utilização intracelular destes produtos de degradação, ou conversão de conjugados de cisteína (Cys-SR) em ácido mercaptúrico. O catabolismo de conjugados de glutationa leva à formação de conjugados com a cisteína. Estes conjugados são transportados de novo para as células, onde podem funcionar como substrato para as N-acetiltransferases, com o intuito de gerar conjugados com a N-acetilcisteína (N-Acetil-Cys-SR), ou ácidos mercaptúricos. Estes ácidos são depois exportados a partir de células com a finalidade de eliminá-los através da urina ou fezes[12]. Defesa AntioxidanteA ação antioxidante consiste na neutralização de radicais livres e redução do peróxido de hidrogênio. A glutationa é a primeira linha de defesa contra ROS, que o organismo humano concretiza a favor da sua homeostasia[13]. Na célula existem duas formas principais de defesa antioxidante: enzimática e não enzimática. A defesa enzimática compreende várias enzimas do ciclo redox da glutationa (glutationa redutase e glicose-6-fosfato-desidrogenase), sendo mais importante a GPx (Glutationa peroxidase). Existem ainda outros sistemas enzimáticos na defesa antioxidante, que inserem no seu mecanismo a enzima superóxido dismutase (SOD) e a catalase. A primeira faz com que ocorra a dismutação do radical superóxido em peróxido de hidrogênio e oxigênio, já a segunda converte o peróxido de hidrogênio em água e oxigênio molecular. É através destes sistemas que muitas das reações prejudiciais são evitadas ou alteradas[14]. DestoxificaçãoO metabolismo de xenobióticos manifesta-se em duas etapas: funcionalização (fase I), onde o componente a ser excretado sofre uma alteração química da molécula, que pode ser provocada por oxidação, redução ou hidrólise; conjunção (fase II), onde a molécula vai ser preparada para poder ser expulsa pelo organismo, para isso acopla-se a molécula que servirá como meio de transporte. A fase II só é funcional caso haja um grupo reativo adequado para a conjugação, esse grupo reativo necessário à fase II é adquirido com a primeira fase[15]. A conjugação dos xenobióticos com a glutationa, efetuando a destoxificação, é catalisada por uma família de GST (Glutationa-S-transferase). Estas enzimas estão presentes na maioria dos tecidos, embora em concentrações mais elevadas no fígado, intestino, rim, testículos, glândula supra-renal e pulmão, onde se localizam no citoplasma numa percentagem de 95%, e no retículo endoplasmático cerca de 5%[16]. Na saúdeA glutationa é uma molécula determinante em diversos processos celulares e como tal, qualquer alteração na sua homeostasia pode influenciar a etiologia e/ou progressão de diversas doenças humanas[17]. Diversos estudos descrevem o decréscimo dos níveis de glutationa com o aumento da idade de uma pessoa, estando assim implicado com o aparecimento de certas doenças associadas ao envelhecimento[18]. Os níveis de glutationa são um indicador muito sensível da funcionalidade e viabilidade celular[19]. Características físicas
Ligações externasReferências
|
||||||||||||||||||||||||||||||||||||||||||||||||