此條目介紹的是氟的化合物和结构。关于应用和性质,请见「
氟 」。
氟作为直线型 (a) 或角形 (b) 的桥接配体[ 1] 氟 可以形成很多化合物,但里面的氟原子的氧化态 基本为 −1。它会和其它原子成键,形成极性共价键或离子键。氟肯定只能形成一个单键 ,尽管有至少两个X-氟键的键级超过1的情况(一氟化硼 和一氟化氮 )。[ 2] 桥连配体 。含氟分子也可能表现出氢键 (与某些非金属的较弱桥键)。[ 3] [ note 1] #元素最高氧化态:氟化物vs氧化物 )[ 4]
一个氟原子有一个不成对的电子,而氟气分子(F2 )没有不成对的电子。这使得它是反磁性 (被磁铁稍微排斥)的,磁化率 为−1.2×10−4 (SI ),接近理论上的预测。[ 5] 顺磁性 (被磁铁吸引)的。
卤素键键能 (kJ/mol)
X
XX
HX
BX3
AlX3
CX4
F 159
574
645
582
456
Cl
243
428
444
427
327
Br
193
363
368
360
272
I
151
294
272
285
239
相较于更重的卤素双原子分子,氟气中氟–氟键的键能较弱。它的键能比Cl2 或 Br2 分子低,这点与同个周期的过氧化物 的氧–氧键和肼 里的氮–氮键类似。[ 8] 2 分子的氟的共价半径是71皮米,大于其它化合物中的数据,这是因为两个氟原子之间的吸引力较弱,[ 9] 分子轨道 的相对小的重叠的结果。
F2 里只形成一个键(换句话说,它的键级 只有1),由p电子 对组成,和其它卤素分子X2 一样。但是,其它卤素的p轨道混杂了一点d轨道电子,使键级增大。举个例子,氯气的键级为1.12。[ 11] 价轨道 。[ 11] 2 比 Cl2 弱。此外,F2 中的键级实际上小于1,因为它的p电子轨道与s轨道的混合很小,而s轨道不参与键合。[ 12]
物质和氟元素的反应是很快且爆炸性的。大部分物质是非活性的,诸如粉状钢,玻璃碎片和石棉 纤维之类的物质很容易和冷的氟气反应。木材,甚至水在受到氟射流的刺激下,无需产生火花就可以直接燃烧。[ 14]
氟和金属的反应剧烈度就看那个金属是什么。一般来说,金属 (例如铝、铁和铜) 需要被磨成粉末,不然就会被钝化 ,也就是形成一层氟化物保护层来抵御金属的进一步氟化。碱金属 和氟气反应会发生爆炸,而碱土金属 的反应速度没那么快。抗腐蚀金属 如:钌 、铑 、钯 、铂 和金 要在 300–450 °C (575–850 °F) 下才能和氟气反应。[ 15]
氟和氢气 会发生爆炸性反应,就像和碱金属反应一样。卤素 会和氟气反应,重惰性气体氡 也是如此。[ 18] 氙 和氪 要在特殊情况下反应,而氩 只和氟化氢 在极低温下反应。[ 19] 三键 ,需要放电和高温才能与氟结合。[ 20] 氨 反应,形成氮气和氟化氢 。
氟的化学作用主要由其获得电子的强烈趋势决定。它是元素电负性 最大的,单质氟的氧化性也非常强。把氟的一个电子电离需要很大的能量,已知没有试剂可以氧化 氟,形成正氧化态 。[ 21]
因此,氟的唯一氧化态 为−1。唯一的非负氟化合物是氟气,氧化态为0。此外,氟还可以形成氧化态分别为-½和-⅓的F− 和F− ,它们在低温下稳定,40 K下分解。此外F+ 阳离子还有其衍生物预测是稳定的。[ 23]
氟已知可以和除了氖 和氦 以外的所有元素形成化合物。如果只算氟的二元化合物 ,也就是氟化物 的话,那刚才所说的元素都有氟化物,除了氩 。前99个元素都有已知的氟化物,除了放射性极强的砹 和钫 ,还有惰性的氦、氖和氩。[ 24] 钔 、[ 25] 𬬻 [ 26] 𬭳 形成化合物。[ 27]
作为分子的一部分,氟可以引发很强的诱导效应 。由于这个原因,用氟代替氢的酸的酸性会更强。举个例子,乙酸 和它的氟衍生物:一氟 、二氟和三氟衍生物 以及它们的pKa 值分别是4.74、2.66、1.24和0.23[ note 2] [ 29] 氟锑酸 H 的重要成分。[ 30] H 更强,但是它仍未被分离,也未测得酸性。[ 31]
HF 和 H2 O 的相似性
卤化氢(蓝)和氧族元素的氢化物(红)的沸点: HF 和 H2 O 打破了沸点升高的趋势,这是因为它们形成了氢键 。
HF/ H2 O 混合物的凝固点
氟会和氢反应,形成氟化氢 (HF) ,而它的水溶液叫氢氟酸。H-F 键是少数能够形成氢键的键之一。这个性质会影响氟化氢的特性。由于氢键,氟化氢的性质更像水,而不是像其它的卤化氢,例如HCl 。[ 32] [ 33] [ 34]
HF 液体分子里的氢键使它的黏度 变大。氟化氢要到 20 °C 才沸腾,而更重的卤化氢在 −85 °C 到 −35 °C (−120 °F 到 –30 °F)之间就沸腾了。HF 和水混溶 (在任何浓度下都可以溶解),而其它卤化氢的溶解度有很大差距。氟化氢和水还形成几种固态化合物,最明显的是一种1:1的化合物,它直到-40°C(-40°F)才融化。这比纯氟化氢的熔点高了44°C。
不像其它氢卤酸,例如盐酸 ,氢氟酸水溶液只是弱酸 ,酸度系数 (pKa ) 约为3.19。考虑到HF键的极性 远比HCl,HBr或HI中的键高,HF在水中的弱酸性是与这个矛盾的。对于这种现象的解释很复杂,与氢氟酸,水和氟离子的各种簇的形成趋势以及热力学问题有关。[ note 3] 自我电离键合 氟化氢根 ,HF− )和质子,从而大大提高了它的酸度。[ 38] 醋酸 或类似溶剂中,氢氟酸也是所有氢卤酸中最强的。[ 39] 盐酸 ,硫酸 或硝酸 的酸,也揭示了其潜在的酸性。[ 40] [ 38]
干的氟化氢会溶解低价的金属氟化物。一些分子型氟化物也可溶于 HF。不是氟化物的无机化合物一般会和 HF 反应,而不是溶解。
金属氟化物 和其它金属卤化物不太一样,有不同的晶体结构。在众多案例中,金属氟化物类似金属氧化物 ,有相似的成键和结构。
由于它的高电负性,氟更趋于形成高氧化态的化合物。很多五氟化物和六氟化物已被发现,而其它五卤化物和六卤化物则较少。在室温下,分子型氟化物可以是固体,液体或是气体。
氟化物的溶解度变化很大,但随着金属离子上电荷的增加而趋于降低。氟化物溶液呈碱性。[ 46]
氟化钠的结构:紫色的是钠离子,黄绿色的是氟离子 。它们是等电子体 ,不过氟离子更大。这是由于氟离子的核电荷较小而成的。 碱金属 形成一氟化物 。所有可溶的一氟化物都形成岩盐结构 。一些碱土金属氧化物也形成此结构,例如氧化钙。[ 48] 氟化氢盐 ,化学式 MHF2 。在其它一氟化物中,只有氟化银 [ 49] 氟化亚铊 [ 50]
不像全都可溶于水的一氟化物,有些二氟化物不溶于水。一些过渡金属二氟化物,如:氟化铜 和二氟化镍 是可溶于水的。[ 49] 碱土金属 形成的二氟化物 通常不可溶。[ 49] [ 49]
大部分的二氟化物属于萤石结构,以萤石(氟化钙 )命名。(这个结构也被很多二氧化物如:CeO2 ,UO2 ,ThO2 等等形成),其中的金属离子被8个氟离子包围。一些二氟化物采用金红石结构 四方晶系 ,金属原子为八面体配位。
二氟化铍 和其它二氟化物不一样。铍 的电负性更高,形成的键也比其它碱土金属氟化物更共价 (尽管比起其它卤化物还是更离子性 )。BeF2 和SiO2 (石英)有很多相似之处,也都形成原子晶体 。BeF2 具有四面体配位的铍并形成玻璃(很难结晶)。当它结晶时,氟化铍具有与石英相同的室温晶体结构,并且还具有许多在较高温度出现的结构。
二氟化铍极易溶于水,[ 49] 晶格能 。)但是,BeF2 在溶液中或熔融时的电导率比离子性时要低得多。[ 52] [ 54]
二氟化物的晶体或非晶体
萤石结构,是很多二氟化物形成的结构
二氟化铍玻璃的杂乱结构(二维)
很多金属可以形成三氟化物 ,如:铁、铋和稀土元素 ,还有硼族元素 和3族元素 。大部分稀土元素,还有铋的三氟化物,都有YF3 结构。钚、钐(高温下)和镧的三氟化物则有着LaF3 结构。铁和镓的三氟化物有着FeF3 结构,类似于三氧化铼 。只有ScF3 在室温下为立方结构(ReO3 ),这种材料还具有负热膨胀
三氟化金的链状结构 三氟化金采用链接成螺旋状的–AuF4 –正方形连接结构。[ 55] 二聚体 分子。三氟化铝是高熔点固体,气相中是单体,而其它三卤化物是低熔点的挥发性分子或线形聚合物,气相时可形成二聚体。没有一种三氟化物可溶于水,不过一些能溶于其它溶剂。[ 58]
四氟化物 里含有共价键和离子键。锆,铪和许多锕系元素形成四氟化物,其离子结构将金属阳离子置于8配位的四角反棱柱形分子构型 。[ 59] [ 60]
四氟化钛 和四氟化锡 是多聚体,熔点低于 400 °C。拿对应的氯化物相较,四氯化钛 和四氯化锡 在常温下都是液体。四氟化钒 有类似四氟化锡[ 62] 三氟化钒 和五氟化钒 。
铱、铂、钯和铑的四氟化物有一样的结构,直到1975年才被发现。它们具有八面体配位的金属原子,共有四个桥接氟原子和两个未桥接的氟原子。它们的熔点都低于 300 °C。
四氟化锰很不稳定,在常温下也会分解。[ 63] 4 ,是被了解的。在该化合物中,锰形成–MnF6 –八面体,它们共享桥接的氟原子,形成–Mn4 F20 –环,然后进一步连接第三维度。[ 64]
一些四氟化物的结构
ZrF4 ,常见的四氟化物结构
SnF4 的多聚体结构
–Mn4 F20 – 环,可在 MnF4 中找到
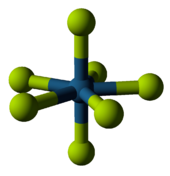
金属的五/六氟化物都是分子型的,有些挥发性。钒 、铌 和钽 形成五氟化物 ,也是它们的最高价电中性氟化物。五氟化钒是唯一的非挥发性高电荷金属氟化物,包含VF6 八面体。五氟化铌和五氟化钽在结构上具有相同的四面体,不同之处在于它们是四聚体,而不是多聚体。
五氟化铋 是挥发性的,也是一种强氟化剂。在固态下,它是聚合物,由八面体的线性链组成,共享轴向氟化物配体。与碱金属结合时,五价铋与氟化物供体反应后可形成六氟铋酸盐([BiF6 ]- ),不管是很强(例如NaF[ 66] 4 [ 68]
很多可以形成六氟化物 的元素也可以形成五氟化物。例如铀 可以形成熟知的六氟化铀 ,也可以形成五氟化铀 。五氟化铀的室温(α)形式具有与五氟化铋相同的线性链结构。UF5 的气态分子具有四方锥 结构。
五氟化铋(或alpha-五氟化铀)的结构
(XF5 )n 链的结构; X=Bi, U。
这些链的包装
可以形成六氟化物 的金属包括九个在元素周期表中央的金属(钼 ,锝 ,钌 ,铑 ,钨 ,铼 ,锇 ,铱 和铂 )以及元素 92–94:铀 ,镎 和钚 。在室温下,六氟化钨 是一种气体。六氟化钼 和六氟化铼 是液体。剩下的金属六氟化物都是挥发性固体。
六氟化铀 金属六氟化物 都是强氧化剂,因为它们都能释放氟。举个例子,六氟化铂 是第一个氧化氧气分子[ 69] [ 70] 钋 也可以形成六氟化物 ,但未被深入研究。
铼是唯一一个可以形成七氟化物 的金属。[ 72] 七氟化铼 的结构是五角双锥形分子构型 。计算表明可能存在的七氟化铱(制备方法被报告[ 74] [ 75]
八氟化 锇在1913年被报告,不过在1958年发现它其实是六氟化锇。[ 77] 8 成功被合成,它会有两个不同长度的Os–F键。[ 78]
七氟化铼
二元非金属 氟化物都是挥发性物质。第2周期元素非金属氟化物和其它周期元素非金属氟化物的性质很不同。举个例子,第2周期元素 的氟化物原子从来没有违背八隅体规则 。(硼 在元素周期表里的特殊位置使它成为例外。)其它周期的非金属氟化物可以形成超价分子 ,例如五氟化磷 和六氟化硫 。[ 79] 三氟化氯 的反应性非常大。
三氟化硼 是平面三角形的分子。其中的硼原子只有六颗价电子(不完全八隅体),会接受路易斯碱 并形成加合物 。三氟化硼会和路易斯碱,如:氨 或另一个氟离子形成加合物,接受它的电子对来完成八隅体。一氟化硼 是一种不稳定的分子,其中有不寻常的硼-氟键。(键级大于1)这个键的键级被描述为1.4(单键和双键之间)。它和N2 是等电子体。[ 81]
路易斯结构显示一氟化硼的三种电子结构。 四氟化硅 ,类似四氟化碳 和四氟化锗 ,是四面体 型结构。[ 82] 4 对加热或电火花稳定,但会与水(甚至潮湿的空气),金属和碱反应,因此显示出弱酸性,与有机镁化合物,醇,胺和氨反应,生成加合物。氟硅酸 ,一种 SiF4 的衍生物,是一种只存在于水溶液中的强酸(无水物不存在)。
氮族元素 的三氟化物和五氟化物在酸性和反应性有类似的趋势。NF3 对水解稳定,[ 85] 3 在湿空气中缓慢水解,而AsF3 完全水解。[ 85] 3 由于与氟的离子键性质增加,因此仅部分水解。它们都是弱路易斯碱,NF3 例外。[ 85] [ 87] [ 87] 五氟化物 仍未知,尽管含有+5氧化态的氮四氟铵 阳离子 (NF+ ) 是已知的。[ 88] 一氟化氮 是在激光研究中观察到的亚稳态分子。它和 O2 是等电子体。此外,和 BF一样,一氟化氮的氮-氟键的键级大于1。[ 2] [ 89]
SF4 不寻常的蹺蹺板形分子構型 ,符合VSEPR 的预测。 氧族元素 氟化物也有类似的性质。它们的四氟化物都不稳定,会水解,也会用它们的孤对电子和酸性氟化物形成加合物。硫和硒的四氟化物是分子型的,而 TeF4 是一种聚合物。[ 90] 6 极度惰性,SeF6 的反应性略高(例如,在 200 °C (400 °F)下可以和氨反应),而 TeF6 可以轻易被水解,形成碲酸 。[ 90] [ 90] OF+ [ 91] 2 F2 、S2 F10 等等)。
稳定的重卤素(氯、溴和碘)都可以形成一氟化物、三氟化物和五氟化物: XF,XF3 和 XF5 。对于七氟化物,只有七氟化碘 是已知的。氯和溴的七氟化物还没被发现,不过去除了一个氟离子形成的ClF+ BrF+ ,都是已知的强氧化剂。砹还没深入了解,尽管一种叫做一氟化砹的物质被报告,[ 96] [ 97] 五氟化氯 具有更高的反应活性。工业上使用的ClF3 需要类似氟气的特殊的预防措施,因为它具有腐蚀性和对人体有害。[ 99]
一些重要的无机酸含氟。由于氟的强电负性,它们一般很强。氟锑酸 (HSbF6 ),是已知最强的电中性酸。[ 30] H+ 的形式):这个化合物有极低的 pKa 值,为 −28 ,比纯硫酸强一京 (1016 ) 倍。[ 30] 乔治·安德鲁·欧拉 因研究此类反应而获得了1994年诺贝尔化学奖。[ 100]
惰性气体 因为价电子层已满,是非常惰性的物质。直到1960年代,没有任何惰性气体化合物被发现。在 1962年,尼尔·巴特利特 发现六氟化铂 可以和氙气反应。他把这种化合物称为六氟合铂酸氙 ,但之后的研究表明其组成并非如此简单,可能是五氟化铂酸一氟化氙(II),[XeF]+ [PtF5 ]− ,或是十一氟化二铂酸一氟化氙(II) ,[XeF]+ [Pt2 F11 ]− 和六氟合铂酸三氟化二氙,[Xe2 F3 ]+ [PtF6 ]− 。尼尔·巴特利特对氙气的氟化已得到高度赞扬。[ 102] 二氟化物 和四氟化物 。之后,其它惰性气体化合物也被发现了。
四氟化氙晶体 氙的氟化物包括二氟化氙 ,四氟化氙 和六氟化氙 。氙还形成各种氟氧化物,例如二氟氧化氙(XeOF2 ),由四氟化氙的水解而成。其较轻的同系物氪 ,也可形成特征明确的化合物,例如二氟化氪 。四氟化氪于1963年被报道,[ 105] 六氟化物 )。[ 106] [ 107]
根据元素周期律 ,氡会更加活泼。二氟化氡 已被获取。[ 96]
钌的最高价氟化物和氧化物
六氟化钌 : 六个氟原子和钌键合,不过钌只有 +6 氧化态。
四氧化钌 :四个氧原子和钌键合,形成 +8 氧化态。
元素的最高氧化态通常出现在二元氟化物中。一些元素的最高氧化态只在氧化物中出现,另一些则是在氟化物中,还有一些则同时在它们两者出现。
对于1–5,10,13–16(氮除外)族,它们的氧化物和氟化物的最高氧化态是一样的。不同之处出现在铬、7–9族、铜、汞、氮和惰性气体。氟化 允许一些元素达到相对较低[ note 4] 二氟化氪 已得到充分研究。同时,对于非常高氧化态的元素来说,它们的最高氧化态分子通常为氧化物而不是氟化物。例如对于挥发性氧化物(七氧化二物和四氧化物),都没有对应的七/八氟化物(铼除外)(例如八氟化钌不存在,[ 109] 四氧化钌 已有工业用途。[ 110] [ note 5] IF− ),八氟化锆阴离子(ZrF4− )和八氟化氙阴离子 (XeF2− )是已知的。
最高氧化态的化合物没有很大的用途,甚至是工业用途。例如,四氟化汞 ,第一个含有超越+2氧化态的12族元素 组成的化合物,打破了5d-壳层,展示了相对论效应对原子的影响,并支持汞 、镉 和锌 为过渡金属 。[ 112] [ 113] CoF+ 阳离子,仅在气相中观察到(没有与其他原子的相互作用,因此在任何化学环境中均未显示出稳定性)。[ 109] NF NF 和F 、NF• 和F 、NF 等等。其中,NF +F 系统的能量最低,最稳定。不过,如果NF 分子真的被合成,它必须经历一个高能过渡态,之后才能分解成两个分子。但是,由于过渡态的能量高于六原子分子,因此需要添加能量以达到过渡态,从而允许五氟化氮分解。该能量称为活化能。所以,如果只有极低能量(低温下),这个化合物就可以存在。但是,如何制备五氟化氮是未被解决的问题。
碳氟键 是有机化学中最强的键。[ 115]
较小分子的碳氟键以三种主要方式形成:氟取代卤素或氢,或通过双键/三键加成。碳氢化合物与氟气的直接反应可能具有极危险的反应性,因此反应温度甚至可能需要降低至-150℃(-240 F)。固态氟载体是在加热时会释放氟的化合物,尤其是三氟化钴 或氟化氢可以用来氟化。由于氢和氟的范德华半径类似,经过氟化反应后,分子的大小变化不明显。当涉及到有机卤素化合物或不饱和化合物的反应时,或者当需要合成全氟化合物时(通常直接使用电解氟化 ),直接氟化作用变得不再重要。含氟聚合物是通过聚合 自由基形成的。用于烃类聚合物的其他技术不能与用于含氟聚合物。
有机氟化合物的范围是多种多样的,反映出有机化学 的复杂性。世界存在着大量具有不同氟取代的小分子以及许多聚合物,对特定领域的研究受到应用的商业价值的推动。[ 121]
一氟烷烃(一个氢原子被氟取代而成的烷烃)可能在化学和热力学方面不稳定,但可溶于许多溶剂;但是随着更多的氟取代氢,稳定性增加,而熔点,沸点以及溶解度降低。当密度和粘度增加时,介电常数,表面张力和折射率都会降低。
部分氟化的烷烃被称为氢氟烃 (HFCs)。如果里面还有其它卤素,也可以形成氟氯烃(CFCs)或氟溴烃(BFCs),以及还有保留氢原子的氢氟氯烃(HCFCs)。它们的性质取决于卤素原子的数量和位置。通常,由于卤素原子的大小和电荷的变化允许更多的分子间吸引力,因此卤素原子的组合甚至进一步提高了沸点。[ 123] 碳-氢键 发生反应,释放出的卤化物使火焰猝灭。[ 123]
反式全氟萘烷 是一种碳氟化合物,常温下为液体。它的沸点比对应的碳氢化合物——萘烷 低。 如果所有氢原子都变成氟原子,产生碳氟化合物 ,一个巨大的区别会因此产生。这些化合物都异常稳定,只有溶于液氨的钠可以在常温下攻击它们。它们也非常难溶,几乎没有有机溶剂能够溶解它们。
不过,如果一种碳氟化合物含有双键/三键(全氟烯烃 或全氟炔烃 ),产物会有极高反应性,甚至比对应的碳氢化合物有更高活性。例子:二氟乙炔 甚至会在液氮 温度下分解[ 125] 马氏规则 )。
全氟化合物 ,和只由碳和氟组成的碳氟化合物不同,它有其它官能团。[ 127] [ 128]
全氟磺酸的酸性很强。甲磺酸的全氟化合物,三氟甲磺酸 的酸性足以和高氯酸 比较。这些化合物有较低的表面能。因此,全氟辛磺酸 已在工业上用作表面活性剂。
含氟聚合物在许多方面都与对应的小分子相似。将氟添加到聚合物中会以与小分子相同的方式影响性能(增加化学稳定性,熔点,降低可燃性,溶解度等)。但是,每种含氟聚合物都具有自己的特性。
最简单的含氟塑料是聚四氟乙烯 (PTFE,DuPont 品牌名为 Teflon),由结构单元 2 –组成。PTFE有很长的碳链,支链都是氟原子。它没有氢原子,可以看作是聚乙烯 (结构单元 –CH2 –)的全氟化合物。类似其它碳氟化合物,PTFE有比聚乙烯高的化学和热稳定性。它对范德华力 的抵抗使得 PTFE 是唯一一种壁虎 无法粘附的表面。[ 130] 聚全氟乙烯丙烯 聚全氟乙烯甲乙烯醚
除了聚四氟乙烯,还有很多种氟代塑料。聚偏二氟乙烯 (PVDF,结构单元–CF2 CH2 –),有PTFE的一半氟原子。PVF(聚氟乙烯 ,结构单元 –CH2 CHF–)则有PTFE的四分之一氟原子。PCTFE(聚氯三氟乙烯 ,结构单元–CF2 CFCl–)是另一种重要的化合物。它与PTFE的不同之处在于用氯取代了四分之一的氟,但这种差异带来了更大的硬度、抗蠕变性和水分持久性。
对聚乙烯氟化并不会使它的氢原子都变成氟原子,只有一层薄层(最多 0.01 mm)会被氟化影响。这有点类似于金属钝化。因此,如果只有表面很重要,它们是全氟塑料更便宜的替代品。[ 133]
Nafion的复杂结构 Nafion 磺酸基 (–SO2 OH) 结束。它的化学稳定性很高,确切的性质随形态而变化。然而,由于化学结构复杂,通过添加阳离子(如 Na+ ),Nafion会相对容易地转化为离聚物 [ 134]
类似其它弹性体 (人造橡胶),氟弹性体由三个维度连接的无序聚合物链组成。制造氟弹性体的主要挑战是交联(与非反应性的聚合物反应),以及去除固化 过程中形成的HF。氟弹性体主要有三类:VDF/HFP 是偏二氟乙烯和(至少20%的)六氟丙烯的共聚系统。TFE/丙烯 则是另一种对某些溶剂具有更好耐化学性的共聚系统。TFE/PMVE(全氟甲基乙烯基醚)是一种共聚物系统,可产生全氟代的氟弹性体。[ 135]
^ 在这个条目里,类金属 不会从金属和非金属分开,而是归类于更接近的族。举个例子,锗 被看作是一个金属,而硅 是非金属。锑 在此条目是个非金属,尽管它的性质更像一个金属。惰性气体在这个条目会和其它非金属隔开 ,氢是在氟化氢和氢氟酸 章节而碳是在有机氟化合物 章节里。p区 的第7周期元素 的氟化合物还没被研究,就不说它们的氟化合物了。
^ 较低的值代表较强的酸性,注意这是对数。
^ 参见这篇文章来获得更多资料。[ 37]
^ 没有“相对较低”或“相对较高”的界限,它们依赖于元素的性质(并且仅针对最高价氧化物和最高价氟化物处于不同氧化态的元素)。一般来说,+7和+8是高氧化态,而+4或以下是低氧化态。+5和+6则看原子性质,例如原子半径。对于较小的氮原子,+5是高氧化态,不过对于较大的钌原子和锇原子,+6仍然是低氧化态。
^ 注意这里所说的是分子型氟化物,而其它类型的极高价氟化物也不太可能存在。这些化合物不可能是完全离子性的,因为原子极高的第六/七/八电离能使反应无法进行(尽管八氟化锇可能是完全离子性的)[ 78]
^ Calderazzo, Fausto. Halide-bridged polymers of divalent metals with donor ligands – Structures and properties. Coordination Chemistry Reviews. 2010, 254 (5–6): 537–554. doi:10.1016/j.ccr.2009.08.007 ^ 2.0 2.1 Harbison, G. S. The Electric Dipole Polarity of the Ground and Low-lying Metastable Excited States of NF. Journal of the American Chemical Society. 2002, 124 (3): 366–367. PMID 11792193 doi:10.1021/ja0159261 ^ Smart, Bruce E.; Tatlow, J. C. Organofluorine chemistry: Principles and commercial applications. Springer. 1994: 515. ISBN 978-0306446108 ^ Riedel, S.; Kaupp, M. The Highest Oxidation States of the Transition Metal Elements (PDF) . Coordination Chemistry Reviews. 2009, 253 (5–6): 606–624 [2021-08-11 ] . doi:10.1016/j.ccr.2008.07.014 原始内容 (PDF) 存档于2013-06-04). ^ Cheng, H.; Fowler, D. E.; Henderson, P. B.; Hobbs, J. P.; Pascaloni, M. R. On the magnetic susceptibility of fluorine. Journal of Physical Chemistry A. 1999, 103 (15): 2861–2866. Bibcode:1999JPCA..103.2861C doi:10.1021/jp9844720 ^ Macomber, Roger S. Organic chemistry 1 . University Science Books. 1996: 230 [2011-07-26 ] . ISBN 978-0-935702-90-3存档 于2021-04-14). ^ Hemat, R. A. S. Water 42 . Urotext. 2009: 707–709. ISBN 9781903737125 ^ 11.0 11.1 Akhmetov, N. S. Общая и неорганическая химия [General and inorganic chemistry] 4th. Академик[Akademik]. 2001: 317. ISBN 978-5-06-003363-2(俄语) . ^ Bridgeman, Adam J. The Mayer bond order as a tool in inorganic chemistry†. Journal of the Chemical Society, Dalton Transactions. 2001, (14): 2095–2108. doi:10.1039/B102094N ^ Nelson, Eugene W. ' Bad man' of the elements88 (2): 106–108, 260 [2021-08-11 ] . (原始内容存档 于2021-04-14). ^ Lidin, Molochko & Andreeva 2000 ,第442–455頁.^ Pitzer, Kenneth S. Fluorides of radon and element 118 . Journal of the Chemical Society, Chemical Communications. 1975, (18): 760b–761 [2021-08-11 ] . doi:10.1039/C3975000760B 存档 于2021-04-14). ^ Khriachtchev, Leonid; Pettersson, Mika; Runeberg, Nino; Lundell, Jan; Räsänen, Markku. A stable argon compound. Nature. 2000, 406 (6798): 874–876. Bibcode:2000Natur.406..874K PMID 10972285 doi:10.1038/35022551 ^ Lidin, Molochko & Andreeva 2000 ,第252頁.^ Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. Principles of chemistry: The molecular Science . Cengage Learning. 2010: 156 [2011-05-07 ] . ISBN 978-0-495-39079-4 ^ Schlöder, T.; Riedel, S. Investigation of Heterodimeric and Homodimeric Radical Cations of the Series:[F2 O2 ]+ ,[F2 Cl2 ]+ ,[Cl2 O2 ]+ ,[F4 ]+ , and[Cl4 ]+ . RSC Advances . 2012, 2 (3): 876–881. doi:10.1039/C1RA00804H ^ Young, J. P.; Haire, R. G.; Peterson, J. R.; Ensor, D. D.; Fellow, R. L. Chemical consequences of radioactive decay. 2. spectrophotometric study of the ingrowth of berkelium-249 and californium-249 into halides of einsteinium-253. Inorganic Chemistry. 1981, 20 (11): 3979–3983. doi:10.1021/ic50225a076 ^ Hulet, E. K. Mendelevium: Divalency and Other Chemical Properties. Science. 1967, 158 (3800): 486–8. Bibcode:1967Sci...158..486H PMID 17749069 doi:10.1126/science.158.3800.486 ^ Kratz, J. V. Critical evaluation of the chemical properties of the transactinide elements (IUPAC Technical Report). Pure and Applied Chemistry. 2003, 75 (1): 103. doi:10.1351/pac200375010103 ^ Kahn, Bernd. Radioanalytical chemistry . 2007 [2011-05-04 ] . ISBN 978-0-387-34122-4存档 于2017-02-28). ^ Acids and bases . askthenerd.com. 2011 [2012-08-18 ] . (原始内容存档 于2016-03-04). ^ 30.0 30.1 30.2 Olah, George A. Crossing conventional boundaries in half a century of research. Journal of Organic Chemistry . 2005, 70 (7): 2413–2429. PMID 15787527 doi:10.1021/jo040285o ^ Hwang, I. C.; Seppelt, K. Gold Pentafluoride: Structure and Fluoride Ion Affinity This work was supported by the Deutsche Forschungsgemeinschaft and the Fond der Chemischen Industrie. Angewandte Chemie International Edition. 2001, 40 (19): 3690–3693. PMID 11592224 doi:10.1002/1521-3773(20011001)40:19<3690::AID-ANIE3690>3.0.CO;2-5 ^ Pauling, Linus A. The nature of the chemical bond and the structure of molecules and crystals: An introduction to modern structural chemistry 454 –464. ISBN 978-0-8014-0333-0 ^ Atkins, Peter; Jones, Loretta. Chemical principles: The quest for insight . W. H. Freeman & Co. 2008: 184–185 [2021-08-11 ] . ISBN 978-1-4292-0965-6存档 于2021-04-30). ^ Emsley, John. The hidden strength of hydrogen . New Scientist. 1981, 91 (1264): 291–292 [2012-12-25 ] . (原始内容存档 于2021-04-30). ^ Clark, Jim. The acidity of the hydrogen halides . [2011-09-04 ] . (原始内容存档 于2012-12-24). ^ 38.0 38.1 Chambers, C.; Holliday, A. K. Modern inorganic chemistry (An intermediate text) (PDF) . The Butterworth Group. 1975: 328–329 [2013-05-03 ] . (原始内容 (PDF) 存档于2013-03-23). ^ Hannan, Henry J. Technician's formulation handbook for industrial and household cleaning Products . Lulu.com. 1975: 31 [2021-08-11 ] . ISBN 9780615156019存档 于2021-07-23). ^ Hannan, Henry J. Course in chemistry for IIT-JEE 2011 . Tata McGraw Hill Education Private Limited. 2010: 15–22 [2021-08-11 ] . ISBN 9780070703360存档 于2021-07-23). ^ Oxtoby, David W.; Gillis, H. Pat; Campion, Alan. Principle of Modern Chemistry . Cengage Learning. 2012: 693 . ISBN 9780840049315 ^ Arai, Toshihiro. Mesoscopic Materials and Clusters: Their Physical and Chemical Properties . Springer. 1999: 267. ISBN 9783540648840 ^ 49.0 49.1 49.2 49.3 49.4 Storer, Frank Humphreys. First Outlines of a Dictionary of Solubilities of Chemical Substances. Cambridge. 1864: 278–80. ISBN 978-1-176-62256-2 ^ Remy, Heinrich. Treatise on Inorganic Chemistry: Introduction and main groups of the periodic table . Elsevier Publishing Company. 1956: 383 . ^ Walsh, Kenneth A. Beryllium chemistry and processing . ASM International. 2009-01-01: 99–102, 118–119 [2021-08-11 ] . ISBN 978-0-87170-721-5存档 于2021-07-23). ^ Hertz, Raymond K. General analytical chemistry of beryllium . Coyle, Francis T. (编). Chemical analysis of metals: a symposium. ASTM. 1987: 74–75 [2021-08-11 ] . ISBN 978-0-8031-0942-1存档 于2021-07-23). ^ F. W. B. Einstein; P. R. Rao; James Trotter; Neil Bartlett. The crystal structure of gold trifluoride. Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1967, 4 : 478–482. doi:10.1039/J19670000478 ^ Sobolev, Boris Petrovich. The Rare Earth Trifluorides: Introduction to materials science of multicomponent metal fluoride crystals. Institut d'Estudis Catalans. 2001: 51. ISBN 978-84-7283-610-5 ^ Kern, S.; Hayward, J.; Roberts, S.; Richardson, J. W.; Rotella, F. J.; Soderholm, L.; Cort, B.; Tinkle, M.; West, M.; Hoisington, D.; Lander, G. A. Temperature Variation of the Structural Parameters in Actinide Tetrafluorides . The Journal of Chemical Physics. 1994, 101 (11): 9333–9337 [2021-08-11 ] . Bibcode:1994JChPh.101.9333K doi:10.1063/1.467963 存档 于2021-04-14). ^ Brown, Paul L.; Mompean, Federico J.; Perrone, Jane; Illemassène, Myriam. Chemical Thermodynamics of Zirconium . Gulf Professional Publishing. 2005: 144 [2021-08-11 ] . ISBN 978-0-444-51803-3存档 于2019-08-11). ^ Becker, S.; Müller, B. G. Vanadium Tetrafluoride. Angewandte Chemie International Edition in English. 1990, 29 (4): 406–407. doi:10.1002/anie.199004061 ^ Brown, David; Canterford, J. H.; Colton, Ray. Halides of the Transition Elements: Halides of the first row transition metals, by R. Colton and J. H. Canterford . Wiley. 2009: 213 [2012-06-06 ] . (原始内容存档 于2021-07-23). ^ Nakajimȧ, Tsuyoshi; Žemva, Boris; Tressaud, Alain. Advanced Inorganic Fluorides: Synthesis, Characterization, and Applications 111 . ISBN 978-0444720023 ^ Breunig, Hans Joachim. Bismuth compounds . Kirk-Othmer Encyclopedia of Chemical Technology Volume 4. John Wiley & Sons. : 22 [2021-08-11 ] . (原始内容存档 于2013-07-19). ^ Suzuki, Hitomi; Matano, Yoshihiro. Organobismuth chemistry 8 . ISBN 978-0-444-20528-5 ^ Bartlett, Neil; Lohmann, D. H. Dioxygenyl hexafluoroplatinate (V), O2 + [PtF6 ]− . Proceedings of the Chemical Society. 1962, (3): 115. doi:10.1039/PS9620000097 ^ Bartlett, Neil. Xenon hexafluoroplatinate (V) Xe+ [PtF6 ]− . Proceedings of the Chemical Society. 1962, (6): 218. doi:10.1039/PS9620000197 ^ Vogt, T.; Fitch, A. N.; Cockcroft, J. K. Crystal and molecular structures of rhenium heptafluoride. Science. 1994, 263 (5151): 1265–67. Bibcode:1994Sci...263.1265V PMID 17817431 doi:10.1126/science.263.5151.1265 ^ Technische Universität Berlin. Prediction of new compounds and new oxidation states . 2012 [2012-05-24 ] . (原始内容存档 于2021-07-24). ^ Riedel, S.; Kaupp, M. The highest oxidation states of the transition metal elements. Coordination Chemistry Reviews. 2009, 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014 ^ Weinstock, Bernard; Malm, John G. Osmium Hexafluoride and its Identity with the Previously Reported Octafluoride. Journal of the American Chemical Society. September 1958, 80 (17): 4466–4468. doi:10.1021/ja01550a007 ^ 78.0 78.1 Weldkamp, Achim; Frenking, Gernot. Quantum-mechanical ab initio investigation of the transition-metal compounds OsO4 , OsO3 F2 , OsO2 F4 , OsOF6 , and OsF8 . Chemische Berichte. 1993, 126 (6): 1325–1330. doi:10.1002/cber.19931260609 ^ Noury, Stephane; Silvi, Bernard; Gillespie, Ronald J. Chemical bonding in hypervalent molecules: Is the octet rule relevant? (PDF) . Inorganic Chemistry. 2002, 41 (8): 2164–2172 [2012-05-23 ] . PMID 11952370 doi:10.1021/ic011003v 存档 于2020-05-11). ^ Martinie, R. J.; Bultema, J. J.; van der Wal, M. N.; Burkhart, B. J.; van der Griend, D. A.; de Kock, R. L. Bond order and chemical properties of BF, CO, and N2 (PDF) . Journal of Chemical Education. 2011, 88 (8): 1094–1097 [2021-08-11 ] . Bibcode:2011JChEd..88.1094M doi:10.1021/ed100758t 存档 (PDF) 于2017-08-09). ^ Ellis, Bryan David. Scientific essentialism . Cambridge University Press. 2001: 69 . ISBN 978-0521800945 ^ 85.0 85.1 85.2 Raghavan, P. S. Concepts and problems in inorganic Chemistry . Discovery Publishing House. 1998: 164–165 [2021-08-11 ] . ISBN 9788171414185存档 于2016-06-17). ^ 87.0 87.1 Norman, Nicholas C. Chemistry of arsenic, antimony and bismuth . Springer. 1998: 97 [2021-08-11 ] . ISBN 978-0751403893存档 于2021-07-23). ^ Christe, K. O.; Wilson, W. W. Synthesis and characterization of NF+ BrF− and NF+ BrF− . Inorganic Chemistry. 1986, 25 (11): 1904–1906. doi:10.1021/ic00231a038 ^ Davis, Steven J.; Rawlins, Wilson T.; Piper, Lawrence G. Rate coefficient for the H + NF(a1 Δ) reaction (PDF) . The Journal of Physical Chemistry. 1989, 93 (3): 1078–1082 [2021-08-11 ] . doi:10.1021/j100340a013 存档 (PDF) 于2021-08-29). ^ 90.0 90.1 90.2 Murthy, C. Parameshwara. University chemistry, Tom 1. New Age International. 2008: 180–182, 206–208. ISBN 978-8122407426 ^ Crawford, M.; Klapötke, T. M. The trifluorooxonium cation, OF+ . Journal of Fluorine Chemistry. 1999, 99 (2): 151–156. doi:10.1016/S0022-1139(99)00139-6 ^ 96.0 96.1 Pitzer, Kenneth Sanborn (编). Molecular structure and statistical thermodynamics: Selected papers of Kenneth S. Pitzer 1 . World Scientific. 1993: 111. ISBN 978-9810214395 ^ Gmelin, Leopold. Gmelin handbook of inorganic chemistry: At—Astatine 8th. Springer-Verlag. 1985-07-03: 224. ISBN 9783540935162 ^ Patnaik, Pradyot. A comprehensive guide to the hazardous properties of chemical substances . John Wiley & Sons. 2007: 478–479 [2021-08-11 ] . ISBN 9780471714583存档 于2016-06-17). ^ The Nobel Prize in chemistry 1994 . nobelprize.org. [2008-12-22 ] . (原始内容存档 于2008-08-13). ^ Chemical and Engineering News as cited by Michael Barnes. Neil Bartlett, emeritus professor of chemistry, dies at 75 . University of California Newsroom. [2011-12-24 ] . (原始内容 存档于2011-10-22). ^ Grosse, A. V.; Kirshenbaum, A. D.; Streng, A. G.; Streng, L. V. Krypton Tetrafluoride: Preparation and Some Properties. Science. 1963, 139 (3559): 1047–1048. Bibcode:1963Sci...139.1047G PMID 17812982 doi:10.1126/science.139.3559.1047 ^ Dixon, D. A.; Wang, T. H.; Grant, D. J.; Peterson, K. A.; Christe, K. O.; Schrobilgen, G. J. Heats of Formation of Krypton Fluorides and Stability Predictions for KrF4 and KrF6 from High Level Electronic Structure Calculations. Inorganic Chemistry. 2007, 46 (23): 10016–10021. PMID 17941630 doi:10.1021/ic701313h ^ Xu, Ruren; Pang, Wenqin; Huo, Qisheng. Main inorganic synthetic chemistry 54 . ISBN 9780444535993 ^ 109.0 109.1 Riedel, S.; Kaupp, M. The highest oxidation states of the transition metal elements. Coordination Chemistry Reviews. 2009, 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014 ^ Technical data sheet 320 Ruthenium tetroxide 0.5% aqueous solution (PDF) . Polysciences, Inc: 1. 2000 [2012-12-28 ] . (原始内容 (PDF) 存档于2011-08-18). ^ Jensen, William B. Is mercury now a transition element?. Journal of Chemical Education. 2008, 85 (9): 1182–1183. Bibcode:2008JChEd..85.1182J doi:10.1021/ed085p1182 ^ Wang, Xuefang; Andrews, Lester; Riedel, Sebastian; Kaupp, Martin. Mercury is a transition metal: The first experimental evidence for HgF4 . Angewandte Chemie. 2007, 119 (44): 8523–8527. doi:10.1002/ange.200703710 ^ O'Hagan, D. Understanding organofluorine chemistry. An introduction to the C–F bond . Chemical Society Reviews. 2008, 37 (2): 308–319. PMID 18197347 doi:10.1039/b711844a ^ Okazoe, Takashi. Overview on the history of organofluorine chemistry from the viewpoint of material industry (PDF) . Proceedings of the Japan Academy, Series B. 2009, 85 (8): 276–289 [2021-08-11 ] . Bibcode:2009PJAB...85..276O PMC 3621566 PMID 19838009 doi:10.2183/pjab.85.276 存档 于2021-05-05). ^ 123.0 123.1 Sukornick, B. Potentially acceptable substitutes for the chlorofluorocarbons. International Journal of Thermophysics . 1989, 10 (3): 553–561. Bibcode:1989IJT....10..553S doi:10.1007/BF00507978 ^ Urben, Peter. Bretherick's Handbook of Reactive Chemical Hazards 7th. Surendra Kumar. 2006: 269. ISBN 9780123725639 ^ Mendicino, L. Environmental issues in the electronics and semiconductor industries. The Electrochemical Society. 1999: 116. ISBN 9781566772303 ^ Knepper, Thomas P.; Lange, Frank T. Polyfluorinated Chemicals and Transformation Products 27 . ISBN 9783642218712 ^ University of California, Berkeley . Research into gecko adhesion . [2011-04-29 ] . (原始内容 存档于2007-10-14). ^ Kharitonov, A. P.; Taege, R.; Ferrier, G.; Piven, N. P. The kinetics and mechanism of the direct fluorination of polyethylenes (PDF) . Surface Coatings International Part B: Coatings Transactions. 2005, 88 (3): 201–212 [2013-05-03 ] . doi:10.1007/BF02699574 原始内容 (PDF) 存档于2013-05-15). ^ Rhoades, David Walter. Broadband dielectric spectroscopy studies of Nafion. 2008: 2. ISBN 9780549785408 ^ Martin, John Wilson. Concise encyclopedia of the structure of materials . Elsevier. 2007: 187–194 [2021-08-11 ] . ISBN 978-0-08-045127-5存档 于2016-06-17).
Bayerische Julius-Maximilians-Universität Würzburg. The Highest Oxidation States of the 5d Transition Metals: a Quantum-Chemical Study (PDF) (报告). Chemical Society. 2006 [2011-06-20 ] . (原始内容存档 (PDF) 于2013-03-23). Emeléus, H. J.; Sharpe, A. G. Advances in Inorganic Chemistry and Radiochemistry 27th. Academic Press. 1983 [2021-08-11 ] . ISBN 978-0-12-023627-5存档 于2021-07-23). Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Butterworth Heinemann. 1998. ISBN 978-0-7506-3365-9 Lewars, Errol G. Modeling marvels: Computational anticipation of novel molecules . Springer. 2008 [2021-08-11 ] . ISBN 978-1-4020-6972-7存档 于2021-04-14). Lide, David R. Handbook of Chemistry and Physics ISBN 978-0-8493-0566-5 Lidin, P. A.; Molochko, V. A.; Andreeva, L. L. Химические свойства неорганических веществ [Chemical properties of inorganic substances]. Khimiya. 2000. ISBN 978-5-7245-1163-6(俄语) . Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. Introduction to modern inorganic chemistry 6th. CRC Press. 2002. ISBN 978-0-7487-6420-4 Ullmann, Franz (编). Encyclopedia of Industrial Chemistry. Wiley-VCH. 2005. ISBN 978-3-527-30673-2 Aigueperse, Jean; Mollard, Paul; Devilliers, Didier; Chemla, Marius; Faron, Robert; Romano, Renée; Cuer, Jean Pierre. Fluorine Compounds, Inorganic. Ullmann's Encyclopedia of Industrial Chemistry. 2000. ISBN 978-3-527-30673-2doi:10.1002/14356007 Carlson, D. Peter; Scmiegel, Walter. Fluoropolymers, Organic. Ullmann's Encyclopedia of Industrial Chemistry. 2000. ISBN 978-3527306732doi:10.1002/14356007.a11_393 Jaccaud, Michael; Faron, Robert; Devilliers, Didier; Romano, René. Fluorine. Ullmann's Encyclopedia of Industrial Chemistry. 2000. ISBN 978-3527306732doi:10.1002/14356007.a11_293 Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick. Inorganic chemistry . Academic Press. 2001 [2011-03-03 ] . ISBN 978-0-12-352651-9存档 于2020-03-21). Yaws, Carl L.; Braker, William. Fluorine. Matheson Gas Data Book, Book 2001 . McGraw-Hill Professional . 2001. ISBN 978-0-07-135854-5
Information related to 氟化合物